Ammoniakgas NH3 kan fremstilles ved at kombinere brint- og nitrogengasser Hvis 28 g af 7 er tilgængelige, hvor mange gram produceres ammoniak?
Den afbalancerede kemiske ligning for reaktionen er:
$$N_2 (g) + 3H_2 (g) \højrepil 2NH_3 (g)$$
Ud fra ligningen kan vi se, at 1 mol nitrogen reagerer med 3 mol brint og producerer 2 mol ammoniak.
Da vi har 28 g nitrogen, lad os konvertere det til mol:
$$Moler \ af \ N_2 =28 \ g / 28 \ g/mol =1 \ mol$$
Lad os nu antage, at vi har et overskud af brintgas. For at bestemme den maksimale mængde ammoniak, der kan produceres, vil vi bruge molforholdet fra den afbalancerede ligning.
$$Moler \ af \ NH_3 \ produceret =1 \ mol \ N_2 \ gange \frac{2 \ mol \ NH_3}{1 \ mol \ N_2} =2 \ mol \ NH_3$$
Til sidst konverterer vi mol ammoniak tilbage til gram:
$$Gram \ af \ NH_3 =2 \ mol \ NH_3 \ gange 17 \ g/mol =34 \ g$$
Hvis der er 28 g kvælstof til rådighed, er den maksimale mængde ammoniak, der kan produceres, derfor 34 gram.
 Varme artikler
Varme artikler
-
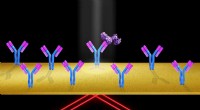 Teknikken tillader praktisk, præcis optisk billeddannelse af individuelle proteinerNår proteinmolekyler (lilla) binder sig til immobiliserede receptormolekyler, (som de Y-formede antistoffer, der er fastgjort til objektglassets overflade), brydningsindekset ved guldoverfladen ændres
Teknikken tillader praktisk, præcis optisk billeddannelse af individuelle proteinerNår proteinmolekyler (lilla) binder sig til immobiliserede receptormolekyler, (som de Y-formede antistoffer, der er fastgjort til objektglassets overflade), brydningsindekset ved guldoverfladen ændres -
 Model til 2-D materialebaseret RRAM fundetResistiv random access -hukommelse lavet af grafenelektroder og hexagonalt bornitrid -dielektrikum. Kredit:Copyright American Institute of Physics 2017. Gengivet med tilladelse fra forfatterne. Gr
Model til 2-D materialebaseret RRAM fundetResistiv random access -hukommelse lavet af grafenelektroder og hexagonalt bornitrid -dielektrikum. Kredit:Copyright American Institute of Physics 2017. Gengivet med tilladelse fra forfatterne. Gr -
 Fysikeres algoritme forudsiger molekylers optiske egenskaberKredit:Tomsk State University Forskere fra Tomsk State University (Rusland), med kolleger fra Sverige og Finland, har skabt en algoritme til beregning af molekylers fotofysiske og luminescerende e
Fysikeres algoritme forudsiger molekylers optiske egenskaberKredit:Tomsk State University Forskere fra Tomsk State University (Rusland), med kolleger fra Sverige og Finland, har skabt en algoritme til beregning af molekylers fotofysiske og luminescerende e -
 Ionledende polymer er afgørende for at forbedre neuromorfe enhederFotografi af en neuromorf enhed brugt i denne undersøgelse. Kredit:Shunsuke Yamamoto Neuromorf refererer til efterligning af adfærden hos hjernens neurale celler. Når man taler om neuromorfe compu
Ionledende polymer er afgørende for at forbedre neuromorfe enhederFotografi af en neuromorf enhed brugt i denne undersøgelse. Kredit:Shunsuke Yamamoto Neuromorf refererer til efterligning af adfærden hos hjernens neurale celler. Når man taler om neuromorfe compu
- Undersøgelse afslører en unik måde for cellemigration på bløde viskoelastiske overflader
- Interstellar Technologies fortsætter arbejdet med sin egen raket trods MOMO-2 lanceringsfejl
- Tidlige kombinerede tests efterligner Ariane 6 liftoff
- Dybets hemmeligheder:Senegals slaveforsker ved skibbrud
- Hvordan restaurering kan hjælpe koralrev
- Hvilket andet opløsningsmiddel kan udover vand bruges til at adskille sigtet methylorange?


