Hvad sker der, når grundstoffet fosfor danner sin ion?
Elektronkonfigurationen af neutralt fosfor (P) er:
2, 8, 5
Når fosfor mister tre valenselektroner, bliver dets elektronkonfiguration:
2, 8, 2
Denne konfiguration er mere stabil, fordi den har et fyldt ydre energiniveau, svarende til ædelgassen neon (Ne). Ved at opnå denne stabile konfiguration får phosphor-ionen en positiv ladning på +3, hvilket gør den til en trivalent kation (P 3+ ).
Dannelsen af P 3+ ioner kan opstå, når fosforatomer reagerer med stærkt elektronegative grundstoffer eller grupper, der har en stærk tendens til at tiltrække elektroner. For eksempel, når fosfor reagerer med ilt i luft, gennemgår det oxidation, mister elektroner til oxygenatomer og danner den ioniske forbindelse fosforpentoxid (P2 O5 ). I denne forbindelse findes phosphoratomer som P 5+ ioner, hvilket indikerer, at hvert fosforatom har mistet fem valenselektroner.
Fosfor kan også danne lavere oxidationstilstande, såsom phosphitionen (PO3 3- ) og hypophosphit-ionen (PO2 3- ), hvor den har oxidationstilstande på henholdsvis +3 og +1. Men P 3+ ion er den mest almindelige og stabile form for fosfor i ioniske forbindelser.
 Varme artikler
Varme artikler
-
 Ædelmetalklynger kan forbedre ydeevnen af katalysatorer og spare ressourcerSkematisk fremstilling af en ædelmetalkatalysator med inaktive enkelte atomer (venstre) og aktive klynger (højre; ædelmetal:hvid; bæremetal:gul; oxygen:rød). Kredit:Florian Maurer, SÆT Milliarder
Ædelmetalklynger kan forbedre ydeevnen af katalysatorer og spare ressourcerSkematisk fremstilling af en ædelmetalkatalysator med inaktive enkelte atomer (venstre) og aktive klynger (højre; ædelmetal:hvid; bæremetal:gul; oxygen:rød). Kredit:Florian Maurer, SÆT Milliarder -
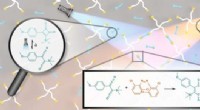 Skærende lysstråler er nøglen til transformativt 3D-printerpotentialeSkematisk reaktionsoversigt. Tofarvet aktivering af et stabilt cyclobutenedion (UV-lys) og rødforskudt ortho-substitueret tetrachlorid-azobenzen (orange lys) muliggør dannelse af ligeret produkt ved p
Skærende lysstråler er nøglen til transformativt 3D-printerpotentialeSkematisk reaktionsoversigt. Tofarvet aktivering af et stabilt cyclobutenedion (UV-lys) og rødforskudt ortho-substitueret tetrachlorid-azobenzen (orange lys) muliggør dannelse af ligeret produkt ved p -
 Fremstilling af metal med luftens lethedEn myg, der står på bomuldsfibre, bærer en prøve af guld-aerogel med ultra-lav densitet. Kredit:Joshua DeOtte Guld, sølv og kobber er tungmetaller, men LLNL-forskere kan nu gøre dem næsten lige så
Fremstilling af metal med luftens lethedEn myg, der står på bomuldsfibre, bærer en prøve af guld-aerogel med ultra-lav densitet. Kredit:Joshua DeOtte Guld, sølv og kobber er tungmetaller, men LLNL-forskere kan nu gøre dem næsten lige så -
 Team fremstiller magneter udelukkende af sjældne jordarter fra USACMI-forsker Ikenna Nlebedim har prøver af neodym-jern-bor-magneter, der er hentet og fremstillet udelukkende i USA. Evnen til at producere sjældne jordarters magneter på hjemmemarkedet kunne give posi
Team fremstiller magneter udelukkende af sjældne jordarter fra USACMI-forsker Ikenna Nlebedim har prøver af neodym-jern-bor-magneter, der er hentet og fremstillet udelukkende i USA. Evnen til at producere sjældne jordarters magneter på hjemmemarkedet kunne give posi
- Sådan laver du et tredimensionelt atom projekt
- Fake news psykologi
- Miljøproblemer forårsaget af mineraler
- Undersøgelse afklarer amerikansk oksekøds ressourceforbrug og drivhusgasemissioner
- Ændringer i jorddækket vil sandsynligvis intensivere tørken i støvskålen
- Manglende gamle mesopotamiske artefakter beslaglagt i Norge


