Fra ethanol og methanol, som er mere opløseligt i vand?
1. Hydrogenbinding: Ethanol har en højere molekylvægt og en større molekylstørrelse sammenlignet med methanol. Tilstedeværelsen af det yderligere carbonatom i ethanol muliggør mere omfattende hydrogenbinding med vandmolekyler. Hydrogenbinding involverer tiltrækningen mellem brintatomet i et molekyle og det elektronegative atom (såsom oxygen eller nitrogen) i et andet molekyle. I tilfælde af ethanol danner hydroxylgruppen (-OH) hydrogenbindinger med vand, hvilket skaber stærkere intermolekylære attraktioner og øger dens opløselighed i vand.
2. Dipolmoment: Dipolmomentet af et molekyle måler dets polaritet, som er den ujævne fordeling af elektrisk ladning. Ethanol har et højere dipolmoment end methanol. Det betyder, at den partielle positive ladning på hydrogenatomet og den partielle negative ladning på oxygenatomet i hydroxylgruppen i ethanol er mere udtalt. Den stærkere polaritet gør det muligt for ethanol at interagere mere gunstigt med vandmolekyler, som også er polære.
3. Molekylær størrelse og struktur: Ethanols større molekylære størrelse sammenlignet med methanol bidrager til dets øgede opløselighed. Methanolmolekyler er mindre og mere kompakte, hvilket giver dem mulighed for at passe tættere sammen i ren methanol. I modsætning hertil introducerer den større størrelse af ethanolmolekyler mere plads mellem dem, hvilket reducerer kompaktheden af den flydende struktur. Dette løsere arrangement gør det lettere for vandmolekyler at trænge ind og opløse ethanolmolekyler, hvilket fører til højere opløselighed.
Sammenfattende bidrager ethanols højere molekylvægt, stærkere hydrogenbinding, højere dipolmoment og større molekylstørrelse alle sammen til dets øgede opløselighed i vand sammenlignet med methanol.
 Varme artikler
Varme artikler
-
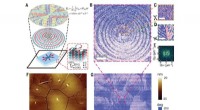 Koncentriske cirkulære polariseringsbånd fundet i en ferroelektrisk polymerObservation af toroidal polær topologi. Kredit: Videnskab (2021). DOI:10.1126/science.abc4727 Et team af forskere fra Kina, USA og Australien har fundet et eksempel på dannelsen af koncentriske
Koncentriske cirkulære polariseringsbånd fundet i en ferroelektrisk polymerObservation af toroidal polær topologi. Kredit: Videnskab (2021). DOI:10.1126/science.abc4727 Et team af forskere fra Kina, USA og Australien har fundet et eksempel på dannelsen af koncentriske -
 Team udvikler kræftbilleddannelseshjælp fra hestekastanjerMolekyler afledt af hestekastanjer hjælper kræftbilleddannelse. Kredit:City College i New York Forskning ved City College i New York viser, at kræftbilleddannelse kan forenkles ved en fotonisk pro
Team udvikler kræftbilleddannelseshjælp fra hestekastanjerMolekyler afledt af hestekastanjer hjælper kræftbilleddannelse. Kredit:City College i New York Forskning ved City College i New York viser, at kræftbilleddannelse kan forenkles ved en fotonisk pro -
 Ny optimeringstilgang hjælper med at designe lettere kulfiberkompositmaterialerForskere fra Tokyo University of Science anvender en designtilgang til kulfibre, der optimerer fiberorientering og tykkelse for at forbedre styrken af fiberforstærket plastik, producerer lettere pla
Ny optimeringstilgang hjælper med at designe lettere kulfiberkompositmaterialerForskere fra Tokyo University of Science anvender en designtilgang til kulfibre, der optimerer fiberorientering og tykkelse for at forbedre styrken af fiberforstærket plastik, producerer lettere pla -
 Opdagelse kan føre til mere potent hvidløg, booster smag og dårlig åndeHannah Valentino, venstre, og Pablo Sobrado, ret, udfører forskning, der lægger grunden til en fremtid, hvor købere kan vælge hvidløg ud fra dets styrke og smagsprofil. Kredit:Virginia Tech I århu
Opdagelse kan føre til mere potent hvidløg, booster smag og dårlig åndeHannah Valentino, venstre, og Pablo Sobrado, ret, udfører forskning, der lægger grunden til en fremtid, hvor købere kan vælge hvidløg ud fra dets styrke og smagsprofil. Kredit:Virginia Tech I århu
- Hvordan frostvæskeproteiner får iskrystaller til at vokse
- Billede:Brændende sydatlantisk solnedgang
- Sådan fungerer Van de Graaff-generatorer
- Daglig grind:Biografien om en stenøkse
- Fysik møder biologi:Hvordan bakterier synkroniserer for at bygge komplekse strukturer
- Forholdet mellem tørke og hungersnød - erfaringer fra Afrikas Horn


