Hvor mange mol CO2 dannes, når 15,5 ml 3,00 M HCl-opløsning reagerer?
2HCl(aq) + Na2CO3(aq) → 2NaCl(aq) + CO2(g) + H2O(l)
Ifølge den afbalancerede kemiske ligning reagerer 2 mol HCl med 1 mol Na2CO3 for at producere 1 mol CO2.
Først skal vi konvertere volumen af HCl-opløsning fra milliliter (mL) til liter (L):
15,5 mL HCl-opløsning =15,5 / 1000 L =0,0155 L
Dernæst kan vi beregne antallet af mol HCl i opløsningen ved hjælp af dens koncentration (3,00 M):
Mol HCl =Koncentration × Volumen
Mol HCl =3,00 M × 0,0155 L =0,0465 mol
Da der kræves 2 mol HCl for at reagere med 1 mol Na2CO3, kan vi bestemme mol CO2 dannet ved hjælp af støkiometri:
Mol CO2 =Mol HCl / 2
Mol CO2 =0,0465 mol HCl / 2 =0,02325 mol
Når 15,5 mL 3,00 M HCl-opløsning reagerer, dannes der derfor 0,02325 mol CO2.
Sidste artikelHvordan opretter man et varmtvandsbad i kemi?
Næste artikelHvordan beregner man valens af sulfat?
 Varme artikler
Varme artikler
-
 Forskere afslører skjulte genetikregler for, hvordan livet på Jorden begyndteI begyndelsen, på en eller anden måde blev grundlæggende genetiske byggesten omsat til proteiner for at føre til komplekst liv, som vi kender det. Kredit:Christ-claude Mowandza-ndinga Alle levende
Forskere afslører skjulte genetikregler for, hvordan livet på Jorden begyndteI begyndelsen, på en eller anden måde blev grundlæggende genetiske byggesten omsat til proteiner for at føre til komplekst liv, som vi kender det. Kredit:Christ-claude Mowandza-ndinga Alle levende -
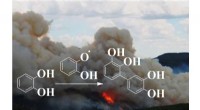 Brunt kulstof fra aromatiske forurenende stoffer udsendes under forbrænding og naturbrandeEn dimeriseringsreaktion af en polyphenol er afbildet til at forløbe ved grænseflader for at bidrage til dannelsen af brunt organisk kulstof under transporten af en røgfane. Kredit:Marcelo Guzman
Brunt kulstof fra aromatiske forurenende stoffer udsendes under forbrænding og naturbrandeEn dimeriseringsreaktion af en polyphenol er afbildet til at forløbe ved grænseflader for at bidrage til dannelsen af brunt organisk kulstof under transporten af en røgfane. Kredit:Marcelo Guzman -
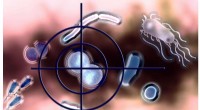 Forskere rapporterer bio-inspirerede selektive antibiotikaSelektive antibiotika muliggør præcisionsindgreb i mikrobiomet (computergrafik). Kredit:Universitetet i Konstanz Da multiresistente bakterier bliver mere og mere en trussel, vi har mere end nogens
Forskere rapporterer bio-inspirerede selektive antibiotikaSelektive antibiotika muliggør præcisionsindgreb i mikrobiomet (computergrafik). Kredit:Universitetet i Konstanz Da multiresistente bakterier bliver mere og mere en trussel, vi har mere end nogens -
 Forskere kaster lys over nyt billigt materiale til at se i mørketDr. Wendy Sarney bruger den molekylære stråleepitaximaskine ved US Army Research Laboratory til at producere infrarøde detektormaterialer med en ny synteseproces. Kredit:US Army Forskere ved U.S.
Forskere kaster lys over nyt billigt materiale til at se i mørketDr. Wendy Sarney bruger den molekylære stråleepitaximaskine ved US Army Research Laboratory til at producere infrarøde detektormaterialer med en ny synteseproces. Kredit:US Army Forskere ved U.S.
- Nye matematiske rammer fastslår risikoen for dramatiske sammenbrud af virkelige netværk
- Hvorfor kæmper amerikanere om skilsmisse uden skyld? Måske kan de ikke blive enige om, hvad ægtes…
- Der er behov for hårdere amerikanske regler om autonome biler:fortaler
- Bevarelse af biodiversitet som en prioritet
- Bæredygtig aminproduktion gennem hydrogenering af amider under milde forhold
- Hvordan markedsføringsansvarlighed kan frigøre den fulde værdi af markedsføring ved at måle og …


