Hvor mange mol CO2 dannes, når 58 g butan C4H10 brænder i ilt?
$$2C_4H_{10} + 13O_2 -> 8CO_2 + 10H_2O$$
Beregn først antallet af mol butan i 58 g:
$$Moles \ C_4H_{10} =\frac{58 g}{58,12 g/mol} =1,00 mol$$
Ifølge den afbalancerede kemiske ligning producerer 2 mol butan 8 mol kuldioxid. Derfor vil 1 mol butan producere:
$$mol \ CO_2 =1,00 mol \ C_4H_{10} \ gange \frac{8 mol \ CO_2}{2 mol \ C_4H_{10}}$$
$$Moles \ CO_2 =4,00 mol$$
Så når 58 g butan brænder i ilt, dannes der 4,00 mol kuldioxid.
Sidste artikelBeregn massen af butan, der skal til for at producere 96,3 kuldioxid?
Næste artikelHvad er uorganiske nitrogenforbindelser?
 Varme artikler
Varme artikler
-
 Fremstilling af metal med luftens lethedEn myg, der står på bomuldsfibre, bærer en prøve af guld-aerogel med ultra-lav densitet. Kredit:Joshua DeOtte Guld, sølv og kobber er tungmetaller, men LLNL-forskere kan nu gøre dem næsten lige så
Fremstilling af metal med luftens lethedEn myg, der står på bomuldsfibre, bærer en prøve af guld-aerogel med ultra-lav densitet. Kredit:Joshua DeOtte Guld, sølv og kobber er tungmetaller, men LLNL-forskere kan nu gøre dem næsten lige så -
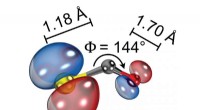 Bestemmelse af strukturen af et molekyle med laserinduceret elektrondiffraktionSkematisk illustration af den molekylære struktur af ioniseret carbonylsulfid (OCS + ) viser dens bøjede og asymmetriske konfiguration og bindingslængderne mellem atomer. Kredit:ICFO Lysmikrosko
Bestemmelse af strukturen af et molekyle med laserinduceret elektrondiffraktionSkematisk illustration af den molekylære struktur af ioniseret carbonylsulfid (OCS + ) viser dens bøjede og asymmetriske konfiguration og bindingslængderne mellem atomer. Kredit:ICFO Lysmikrosko -
 Effektiv optagelse af uran (VI) realiseret af lagdelt manganthiophosphit interkaleret med ammoniumSkematisk diagram over det lagdelte MnPS 3 interkaleret med NH 4 + (N-MPS) til indfangning af U (VI). Kredit:Prof. Huangs gruppe Med den hurtige udvikling af atomkraft på verdensplan, efters
Effektiv optagelse af uran (VI) realiseret af lagdelt manganthiophosphit interkaleret med ammoniumSkematisk diagram over det lagdelte MnPS 3 interkaleret med NH 4 + (N-MPS) til indfangning af U (VI). Kredit:Prof. Huangs gruppe Med den hurtige udvikling af atomkraft på verdensplan, efters -
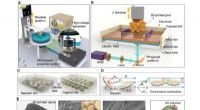 3D-udskrivning elektrisk understøttet, nacre-inspirerede strukturer med selvfølende evnerSkematisk diagram over den elektrisk assisterede 3D-printplatform til konstruktion af nacre-inspirerede strukturer. (A) Diagram over den elektrisk assisterede 3D-udskrivningsenhed. (B) Illustration af
3D-udskrivning elektrisk understøttet, nacre-inspirerede strukturer med selvfølende evnerSkematisk diagram over den elektrisk assisterede 3D-printplatform til konstruktion af nacre-inspirerede strukturer. (A) Diagram over den elektrisk assisterede 3D-udskrivningsenhed. (B) Illustration af
- Stor klimausikkerhed selv ved 1,5 graders temperaturstigning
- Urban SUV'er driver enorm vækst i CO2 -emissioner:IEA
- Fossil antyder aber, gamle verdens aber bevægede sig i modsatte retninger fra fælles forfader
- Hvordan gammelt støv fra havbunden er med til at forklare klimahistorien
- Skriv vrede tanker ned og riv dem i stykker, rådgiver japansk undersøgelse
- Nye fingerspidssensorer, der hjælper veteraner med at føle gennem deres proteser


