Beregn massen af butan, der skal til for at producere 96,3 kuldioxid?
$$2C_4H_{10} + 13O_2 \rightarrow 8CO_2 + 10H_2O$$
Ud fra ligningen kan vi se, at 2 mol butan producerer 8 mol kuldioxid. Den molære masse af butan er 58,12 g/mol, og den molære masse af kuldioxid er 44,01 g/mol. Så massen af butan, der er nødvendig for at producere 96,3 g kuldioxid, er:
$$96,3 g CO_2 \time \frac{2 mol C_4H_{10}}{8 mol CO_2} \time \frac{58,12 g C_4H_{10}}{1 mol C_4H_{10}} =147,3 g C_4H_{10}$$
Derfor skal der 147,3 g butan til for at producere 96,3 g kuldioxid.
Sidste artikelHvad er den elektroniske geometri af sulfit?
Næste artikelHvor mange mol CO2 dannes, når 58 g butan C4H10 brænder i ilt?
 Varme artikler
Varme artikler
-
 Forskere foreslår at bruge pindsvin-lignende partikler til at fremskynde cellebiokemiske reaktionerUrchin-lignende partikler rettet af et magnetfelt. Kredit:Dmitry Lisovsky Forskning fra ITMO foreslår at bruge urchin-lignende partikler styret af et magnetfelt til at fremskynde kemiske reaktione
Forskere foreslår at bruge pindsvin-lignende partikler til at fremskynde cellebiokemiske reaktionerUrchin-lignende partikler rettet af et magnetfelt. Kredit:Dmitry Lisovsky Forskning fra ITMO foreslår at bruge urchin-lignende partikler styret af et magnetfelt til at fremskynde kemiske reaktione -
 Forskere udvikler nyt kombinatorisk proteinbibliotekKombinatoriske biblioteker er en nøglekomponent i kemikerens værktøjssæt til ligandscreening. Dynamiske kombinatoriske biblioteker tilføjer en ny dimension ved at sammenkæde syntese og screening. Nu,
Forskere udvikler nyt kombinatorisk proteinbibliotekKombinatoriske biblioteker er en nøglekomponent i kemikerens værktøjssæt til ligandscreening. Dynamiske kombinatoriske biblioteker tilføjer en ny dimension ved at sammenkæde syntese og screening. Nu, -
 Bioaktive papirbelægninger til erstatning af plast til emballering af fødevarerFig. 1:En genlukkelig pose af papir med belægning på indersiden. Efter brug, emballagen lægges i papiraffaldsbeholderen med de bioaktive materialer. Kredit:Fraunhofer Mængden af plastikaffald st
Bioaktive papirbelægninger til erstatning af plast til emballering af fødevarerFig. 1:En genlukkelig pose af papir med belægning på indersiden. Efter brug, emballagen lægges i papiraffaldsbeholderen med de bioaktive materialer. Kredit:Fraunhofer Mængden af plastikaffald st -
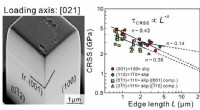 Mikrosøjlekompression til at finde varmetolerante legeringerForskerne målte den plastiske deformation, der skete, da en lille sonde udøvede kraft på mikrosøjleprøverne med forskellige belastningsakseorienteringer. Kredit:National Institute for Materials Scienc
Mikrosøjlekompression til at finde varmetolerante legeringerForskerne målte den plastiske deformation, der skete, da en lille sonde udøvede kraft på mikrosøjleprøverne med forskellige belastningsakseorienteringer. Kredit:National Institute for Materials Scienc
- Fransk videnskabsmand, der leder nuklear fusionsprojekt, dør som 72-årig
- Forskere løser det århundredgamle mysterium om Blood Falls
- Toptrends på Berlins IFA tech messe
- Materialer, der er nødvendige for at lave en dyrecelle Model
- Forskere kaster livline til verdens sjældneste primat
- Rasende debat:Hæmmer aflivning af ulve krybskytteri?


