Hvad ville der ske med entropien i reaktion 2O3 g 3O2 g?
ΔS° =ΣnS°(produkter) - ΣmS°(reaktanter)
hvor ΔS° er standardentropiændringen, n er den støkiometriske koefficient for hvert produkt, m er den støkiometriske koefficient for hver reaktant, og S° er standardentropien for hver art.
For den givne reaktion er standardentropiændringen:
ΔS° =[3S°(O2(g))] - [2S°(O3(g))]
Ved at bruge standardentropiværdierne for O2(g) (205,1 J/mol·K) og O3(g) (238,9 J/mol·K), kan vi beregne entropiændringen:
ΔS° =[3 × 205,1 J/mol·K] - [2 × 238,9 J/mol·K] =-67,5 J/mol·K
Den negative værdi af ΔS° indikerer, at systemets entropi aftager efterhånden som reaktionen skrider frem. Det betyder, at reaktionen fører til et mere ordnet arrangement af molekyler, med færre mulige mikrotilstande.
Sidste artikelHvad er forskellen mellem 1. 2. 3. ioniseringsenergier?
Næste artikelHvad ville der ske med entropien i reaktion 203g 302g?
 Varme artikler
Varme artikler
-
 Hvorfor løg får os til at græde (og hvorfor nogle ikke gør det)Kredit:Shutterstock Mark Anthony i Shakespeares Cleopatra kan have henvist til tårerne, der lever i løget. Men hvorfor får løg os egentlig til at græde? Og hvorfor er det kun nogle løg, der får os
Hvorfor løg får os til at græde (og hvorfor nogle ikke gør det)Kredit:Shutterstock Mark Anthony i Shakespeares Cleopatra kan have henvist til tårerne, der lever i løget. Men hvorfor får løg os egentlig til at græde? Og hvorfor er det kun nogle løg, der får os -
 Kemikere lærer computerprogram til at modellere kræfter mellem atomer nøjagtigtKredit:MIPT Et team af forskere fra MIPT, Skoltech, og Dukhov Research Institute of Automatics, ledet af Artem Oganov, brugte en machine learning -teknik til at modellere opførslen af aluminium
Kemikere lærer computerprogram til at modellere kræfter mellem atomer nøjagtigtKredit:MIPT Et team af forskere fra MIPT, Skoltech, og Dukhov Research Institute of Automatics, ledet af Artem Oganov, brugte en machine learning -teknik til at modellere opførslen af aluminium -
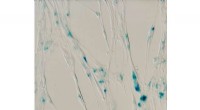 Celler holder op med at dele sig, når dette gen går i højt gear, undersøgelse finderÆldrende celler under et mikroskop. Cellerne - humane lungefibroblaster - blev ældre, efter at de eller nærliggende celler blev gensplejset til at øge aktiviteten af CD36-genet. Områder farvet med b
Celler holder op med at dele sig, når dette gen går i højt gear, undersøgelse finderÆldrende celler under et mikroskop. Cellerne - humane lungefibroblaster - blev ældre, efter at de eller nærliggende celler blev gensplejset til at øge aktiviteten af CD36-genet. Områder farvet med b -
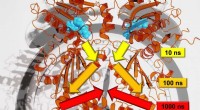 Forskere undersøger signaloverførsel i proteiner på tværs af flere tidsskalaerForskere fra Freiburg har været i stand til at analysere den præcise signaloverførselshastighed på tværs af flere tidsskalaer. Kredit:Steffen Wolf Overvej et øjeblik et træ, der svajer i vinden. H
Forskere undersøger signaloverførsel i proteiner på tværs af flere tidsskalaerForskere fra Freiburg har været i stand til at analysere den præcise signaloverførselshastighed på tværs af flere tidsskalaer. Kredit:Steffen Wolf Overvej et øjeblik et træ, der svajer i vinden. H
- Oversete tendenser i årlig nedbør afslører undervurderede risici på verdensplan
- Luftbobler i gammelt glas afslører produktionsteknik
- Turister evakuerer, da kategori 5 -orkanen Irma nærmer sig Caribien
- Undersøgelse fremhæver bevaringsbehov for fiskearter, der for nylig blev opdaget i det sydvestlige…
- Georgiens guvernør nedlægger veto mod cyberkriminalitetslovgivningen
- Lastpakket Dragon ankommer til rumstationen


