Hvor mange elektroner blev der overført i redoxreaktionen AgNO3 plus Na NaNO3 Ag?
Oxidationshalvreaktion (tab af elektroner):
Na → Na+ + e-
Reduktionshalvreaktion (forstærkning af elektroner):
Ag+ + e- → Ag
For at afbalancere den samlede redoxreaktion skal vi sikre, at det samlede antal elektroner tabt i oxidationshalvreaktionen er lig med det samlede antal elektroner opnået i reduktionshalvreaktionen. I dette tilfælde går en elektron tabt ved oxidationen af Na, og en elektron vindes ved reduktionen af Ag+.
Derfor er antallet af elektroner, der overføres i redoxreaktionen AgNO3 plus Na NaNO3 Ag, én elektron .
 Varme artikler
Varme artikler
-
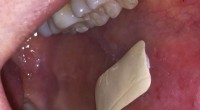 Gips, der sidder inde i munden, kan forbedre behandlingen af orale tilstandeDet bionedbrydelige plaster sidder inde i munden og hjælper med at fremskynde behandlingen af smertefulde sår Kredit:University of Sheffield Et gips, der klæber til indersiden af din mund, rev
Gips, der sidder inde i munden, kan forbedre behandlingen af orale tilstandeDet bionedbrydelige plaster sidder inde i munden og hjælper med at fremskynde behandlingen af smertefulde sår Kredit:University of Sheffield Et gips, der klæber til indersiden af din mund, rev -
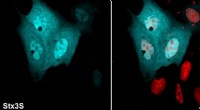 Klasse af proteiner involveret i essentielle cellefunktioner har en uventet rolle, opdager forskereOpløseligt syntaksin 3S (Stx3S) er farvet cyan, og kerner farves med rødt. Kredit:University of California - Santa Barbara I 2013 Nobelprisen i fysiologi eller medicin blev tildelt tre videnskabsm
Klasse af proteiner involveret i essentielle cellefunktioner har en uventet rolle, opdager forskereOpløseligt syntaksin 3S (Stx3S) er farvet cyan, og kerner farves med rødt. Kredit:University of California - Santa Barbara I 2013 Nobelprisen i fysiologi eller medicin blev tildelt tre videnskabsm -
 Implantatinfektioner kan forvises takket være stilladsgennembrudEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH Forskere i Irland har taget et stort skridt fremad i kampen mod medicinske implantatinfektioner. De udviklede en ny type implantat
Implantatinfektioner kan forvises takket være stilladsgennembrudEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH Forskere i Irland har taget et stort skridt fremad i kampen mod medicinske implantatinfektioner. De udviklede en ny type implantat -
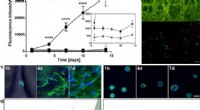 Engineering ECM-lignende fibre med bioaktiv silke til 3-D cellekulturSpredning og udvidelse af celler i FN-silke sammenlignet med når de er indkapslet i en RGD-koblet hydrogel. (a) repræsentativ graf (middelværdi og standardafvigelse) for Alamar Blue-levedygtighedsassa
Engineering ECM-lignende fibre med bioaktiv silke til 3-D cellekulturSpredning og udvidelse af celler i FN-silke sammenlignet med når de er indkapslet i en RGD-koblet hydrogel. (a) repræsentativ graf (middelværdi og standardafvigelse) for Alamar Blue-levedygtighedsassa
- At gå nøgen:Britiske supermarkeder tester plastikfrie zoner
- Forskellige typer legeringer og brug
- Hvordan kunne du sætte et eksperiment op for at bevise, at afbrænding af et papir ikke ændrer det…
- Virksomheder, der overlevede pandemien, vil komme sig
- Bare tonic! Hvordan en eftermiddagstippel lavet af ærter kunne hjælpe med at redde regnskoven
- Primære børn leger ikke selvstændigt udenfor før langt senere end forældregenerationen


