Når et stof fryser, hvad får den flydende fase til at ændre sig til fast fase?
Når temperaturen på en væske sænkes, sænker molekylerne farten og bliver tættere pakket sammen. De tiltrækkende kræfter mellem molekylerne, såsom hydrogenbindinger, van der Waals-kræfter og ionbindinger, bliver stærkere og begynder at overvinde molekylernes kinetiske energi, som er energien i deres bevægelse.
Når tiltrækningskræfterne bliver stærke nok til at overvinde den kinetiske energi, er molekylerne ikke længere i stand til at bevæge sig frit, og de bliver låst fast i en fast position. Det er det, der får væsken til at ændre sig til et fast stof. Den faste fase har en bestemt form og volumen, og molekylerne er arrangeret i et regulært mønster.
Frysepunktet for en væske er den temperatur, hvor den flydende og faste fase er i ligevægt. Ved denne temperatur er frysehastigheden lig med smeltehastigheden, og der er ingen nettoændring i mængden af faste og flydende faser.
Sidste artikelHvorfor er kogende vand en fysisk forandring?
Næste artikelHvorfor er kviksølv dårlig til at dele elektroner?
 Varme artikler
Varme artikler
-
 Krystaløer kan halvere tid og omkostninger ved videnskabelige eksperimenterEn siliciumprøve renses med høj temperatur, i et Omicron VT-AFM/XA multifunktionssystem. Kredit:QUT QUT-forskere har fundet en måde at dyrke krystaløer på, som kan halvere tiden og omkostningerne
Krystaløer kan halvere tid og omkostninger ved videnskabelige eksperimenterEn siliciumprøve renses med høj temperatur, i et Omicron VT-AFM/XA multifunktionssystem. Kredit:QUT QUT-forskere har fundet en måde at dyrke krystaløer på, som kan halvere tiden og omkostningerne -
 Papirbaseret teknologi fremmer tidligere opdagelse af kræftWenji Dong. Kredit:WSU Forskere fra Washington State University har udviklet en teknologi, der er mere end 30 gange mere følsom end nuværende laboratoriebaserede tests til at finde biomarkører for
Papirbaseret teknologi fremmer tidligere opdagelse af kræftWenji Dong. Kredit:WSU Forskere fra Washington State University har udviklet en teknologi, der er mere end 30 gange mere følsom end nuværende laboratoriebaserede tests til at finde biomarkører for -
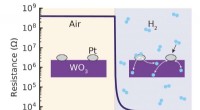 En brintsensor, der fungerer ved stuetemperaturKredit:Delft University of Technology Forskere ved TU Delft har udviklet en meget følsom og alsidig brintsensor, der fungerer ved stuetemperatur. Sensoren er lavet af et tyndt lag af et materiale
En brintsensor, der fungerer ved stuetemperaturKredit:Delft University of Technology Forskere ved TU Delft har udviklet en meget følsom og alsidig brintsensor, der fungerer ved stuetemperatur. Sensoren er lavet af et tyndt lag af et materiale -
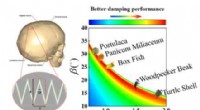 Forholdet mellem sart suturstruktur og dæmpning af biomaterialerFigur 1. De teoretiske modelforudsigelser tyder på, at suturstrukturer fundet i en række naturlige manifestationer har udviklet sig til deres optimale geometrier for at opnå den bedste dæmpningsydelse
Forholdet mellem sart suturstruktur og dæmpning af biomaterialerFigur 1. De teoretiske modelforudsigelser tyder på, at suturstrukturer fundet i en række naturlige manifestationer har udviklet sig til deres optimale geometrier for at opnå den bedste dæmpningsydelse
- Sådan løser du problemproblemer
- Dommer vil ikke stoppe byggeriet af Dakota Access-rørledningen
- Sådan skriver du formler for ioniske forbindelser
- Har jordens ilt rustet månen i milliarder af år?
- Astronomer opdager 21 aktive galaktiske kerner med skiftende udseende
- Sydafrika:Guldmineforurening forgifter Sowetos vand og jord - undersøgelse finder, at madhaver er i…


