Hvorfor er kviksølv dårlig til at dele elektroner?
1. Højt atomnummer:Kviksølv har et atomnummer på 80, hvilket betyder, at det har 80 protoner og 80 elektroner. Tiltrækningen mellem den positivt ladede kerne og valenselektronerne er stærkere i grundstoffer med højere atomnumre. Denne stærke elektrostatiske kraft gør det svært for kviksølv at give slip på sine valenselektroner og dele dem med andre atomer.
2. Fyldte elektronskaller:Kviksølv har en fuldstændig fyldt ydre elektronskal, kendt som 6s subshell. Fyldte elektronskaller er stabile og har en lavenergikonfiguration. For at dele elektroner og danne kemiske bindinger skal et atom have tomme eller delvist fyldte orbitaler i sin yderste skal. Da kviksølvs yderste skal allerede er komplet, er det mindre sandsynligt, at det deltager i elektrondeling.
3. Relativistiske effekter:Relativistiske effekter bliver betydningsfulde for tungere elementer som kviksølv. Ifølge relativitetsteorien, når elektronernes hastighed stiger, stiger deres masse også. I kviksølv fører det høje atomnummer til højere hastigheder for elektronerne i den indre skal. Denne relativistiske effekt får de indre elektroner til at trække sig sammen mod kernen, hvilket gør de yderste elektroner mindre tæt bundet og mere løst holdt. Som følge heraf er valenselektronerne mindre tilgængelige til deling.
4. Stor atomstørrelse:Kviksølv har en relativt stor atomradius sammenlignet med andre grundstoffer i sin gruppe, overgangsmetallerne. Den større atomstørrelse betyder, at kviksølvs valenselektroner er længere væk fra kernen og oplever en svagere elektrostatisk tiltrækning. Denne reducerede tiltrækning gør det lettere for valenselektronerne at blive fjernet eller exciteret, men det gør også, at kviksølv er mindre tilbøjelige til at deltage i kovalent binding ved at dele elektroner.
Sammenfattende bidrager det høje atomnummer, fyldte elektronskaller, relativistiske virkninger og store atomstørrelser af kviksølv til dets dårlige evne til at dele elektroner og danne kemiske bindinger. Kviksølv har en tendens til at udvise metalliske egenskaber, karakteriseret ved delokalisering af valenselektroner i stedet for at dele dem i kovalente bindinger.
 Varme artikler
Varme artikler
-
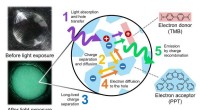 Verdens første demonstration af vedvarende luminescens fra organiske materialer, der skal låse op …En cirkulær film af glød-i-mørke organiske materialer vises i svagt omgivende lys (øverst) og i mørke efter eksponering for ultraviolet lys (nederst). Ultraviolet lys blev brugt til hurtigt at akkumul
Verdens første demonstration af vedvarende luminescens fra organiske materialer, der skal låse op …En cirkulær film af glød-i-mørke organiske materialer vises i svagt omgivende lys (øverst) og i mørke efter eksponering for ultraviolet lys (nederst). Ultraviolet lys blev brugt til hurtigt at akkumul -
 Knap ridser overfladen:En ny måde at lave robuste membraner påEn ny Argonne-teknik kan dyrke materiale inde i membranstrukturer, ændre deres kemi uden at påvirke poreformen markant. Dette giver forskere mulighed for at forbedre membraner på forskellige måder. Kr
Knap ridser overfladen:En ny måde at lave robuste membraner påEn ny Argonne-teknik kan dyrke materiale inde i membranstrukturer, ændre deres kemi uden at påvirke poreformen markant. Dette giver forskere mulighed for at forbedre membraner på forskellige måder. Kr -
 Ny forskning identificerer Fukushima -reaktormateriale i miljøetEt 3D-billede, der tillod forskerne at opdage fordelingen af elementer i prøven. Kredit:University of Bristol/Diamond Light Source Gennem analyse af specifikke nedfaldspartikler i miljøet, et fæ
Ny forskning identificerer Fukushima -reaktormateriale i miljøetEt 3D-billede, der tillod forskerne at opdage fordelingen af elementer i prøven. Kredit:University of Bristol/Diamond Light Source Gennem analyse af specifikke nedfaldspartikler i miljøet, et fæ -
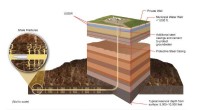 Producerer gavnlig propylen, mens der forbruges en større drivhusgasProducerbare dele af skifergasformationer er placeret mange tusinde fod under landoverfladen, langt under underjordiske drikkevandskilder (USDW). Moderne hydraulisk fraktureringsteknologi involverer s
Producerer gavnlig propylen, mens der forbruges en større drivhusgasProducerbare dele af skifergasformationer er placeret mange tusinde fod under landoverfladen, langt under underjordiske drikkevandskilder (USDW). Moderne hydraulisk fraktureringsteknologi involverer s
- Superbugs fundet på Rio olympiske svømmesteder
- Forskere opdager flere mælkevejslignende galakser i det tidlige univers, hvilket fremmer vores fors…
- Udgravning af grave begynder på stedet for den sorte koloniale kirke
- Gasgiganter:Kan vi forhindre køer i at udlede så meget metan?
- Ingeniører opfinder en ikke -invasiv teknik til at korrigere synet
- Billede:Rumantenne


