Hvordan hænger emnerne om iondannelse og periodiske tendenser sammen?
1. Valenselektroner:Antallet af valenselektroner bestemmer i høj grad, hvor let et grundstof danner ioner. Grundstoffer i samme gruppe (lodret kolonne) i det periodiske system deler det samme antal valenselektroner. Denne lighed fører til lignende ioniseringsmønstre.
2. Ioniseringsenergi:Ioniseringsenergi er den energi, der kræves for at fjerne en elektron fra et neutralt atom. Grundstoffer med lav ioniseringsenergi har en tendens til let at miste elektroner og danne positive ioner (kationer). Når du bevæger dig ned ad en gruppe, falder ioniseringsenergien generelt, fordi det bliver nemmere at fjerne en elektron fra den yderste skal.
3. Elektronegativitet:Elektronegativitet måler et atoms evne til at tiltrække elektroner. Jo højere elektronegativiteten er, jo mere tiltrækker et atom elektroner mod sig selv. Over en periode (vandret række) øges elektronegativiteten generelt fra venstre mod højre. Grundstoffer med høj elektronegativitet har større tendens til at få elektroner og danne negative ioner (anioner).
4. Ionisk radius:Ionisk radius refererer til størrelsen af en ion. Kationer er typisk mindre end deres neutrale modstykker på grund af tab af elektroner. Anioner, på den anden side, er større end deres neutrale atomer, fordi de har flere elektroner. Størrelsen af ioner følger periodiske tendenser, hvor grundstoffer i samme periode har lignende ioniske radier.
5. Stabilitet af ioner:Periodiske tendenser hjælper også med at forudsige stabiliteten af ioner. Generelt er ioner med en fuldstændig yderste elektronskal (ædelgaskonfiguration) de mest stabile. For eksempel har alkalimetaller (Gruppe 1) tendens til at miste deres enkeltvalenselektron for at opnå en stabil ædelgaskonfiguration, der danner stabile kationer. Halogener (Gruppe 17) får let en elektron for at færdiggøre deres ydre skal, hvilket resulterer i stabile anioner.
6. Ionladning:Ladningen af en ion er relateret til antallet af elektroner opnået eller tabt. Grundstoffer i det periodiske system har tendens til at danne ioner med en ladning svarende til deres gruppenummer. For eksempel danner elementer i gruppe 1 1+ ioner, mens dem i gruppe 2 danner 2+ ioner.
Forståelse af iondannelse og periodiske tendenser gør det muligt for forskere at forudsige grundstoffernes adfærd, forklare kemiske egenskaber såsom reaktivitet og binding og rationalisere mønstre observeret i det periodiske system. Det hjælper også med design af materialer med specifikke egenskaber og forståelse af kemiske reaktioner på et grundlæggende niveau.
Sidste artikelHvad er farven på røg nitrogenoxidgas?
Næste artikelEr H2CO polær eller upolær?
 Varme artikler
Varme artikler
-
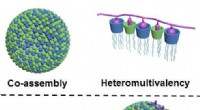 Kemikere udvikler ny metode til selektiv binding af proteinerFigur øverst:Gennem sammontering, to komponenter af lipidtypen danner nano-partikler i vand, som har et meget stort antal forskellige kontaktpunkter (vist med blå og grøn; til venstre). Som et resulta
Kemikere udvikler ny metode til selektiv binding af proteinerFigur øverst:Gennem sammontering, to komponenter af lipidtypen danner nano-partikler i vand, som har et meget stort antal forskellige kontaktpunkter (vist med blå og grøn; til venstre). Som et resulta -
 Ny undersøgelse præsenterer højaktive ozygenerede grupper i kulstofmaterialer til oxygenreduktion…Figur 1. Ydeevnekarakteriseringerne af ORHP. Kredit:Professor Jong-Beom Baek, UNIST Hydrogenperoxid (H 2 O 2 ) har fundet mange anvendelser i den moderne industri, herunder at fungere som en g
Ny undersøgelse præsenterer højaktive ozygenerede grupper i kulstofmaterialer til oxygenreduktion…Figur 1. Ydeevnekarakteriseringerne af ORHP. Kredit:Professor Jong-Beom Baek, UNIST Hydrogenperoxid (H 2 O 2 ) har fundet mange anvendelser i den moderne industri, herunder at fungere som en g -
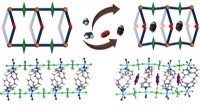 Absorberet pasform til acetylenKredit:Wiley Vi siger ofte, at et substrat passer ind i sit enzym som en nøgle i en lås, men denne metafor er ufuldkommen. Substratbinding kan også ændre låsen (enzymets struktur) for at fremkalde
Absorberet pasform til acetylenKredit:Wiley Vi siger ofte, at et substrat passer ind i sit enzym som en nøgle i en lås, men denne metafor er ufuldkommen. Substratbinding kan også ændre låsen (enzymets struktur) for at fremkalde -
 Metoden undersøger hurtigt atomtynde materialers evne til at producere brintEn teknik udviklet af Rice University og Los Alamos National Laboratory vil give forskere mulighed for hurtigt at undersøge atomtykke materialer for at måle brintproduktion. Rislaboratoriet bruger en
Metoden undersøger hurtigt atomtynde materialers evne til at producere brintEn teknik udviklet af Rice University og Los Alamos National Laboratory vil give forskere mulighed for hurtigt at undersøge atomtykke materialer for at måle brintproduktion. Rislaboratoriet bruger en
- Hvad er pH-værdien for stærkt surt?
- Alstom accepterer at købe Bombardiers jernbanedivision
- Sætter en pris på vådområdernes beskyttende kraft
- Heres Hvordan slutningen af sommertid kan påvirke dig
- Pumpet vandkraft til lagring er en game-changer
- Eksponering af brystkræft ved hjælp af polymerer i nanoskala


