Opløsningen fremstilles ved at opløse 13,3 g ammoniumsulfat i vand nok til at lave 100,0 ml stamopløsning.
For at gøre dette skal du bruge koncentrationen af stamopløsning A og mængden af tilsat prøve:
$$Molaritet =\frac{Moles}{Litre}$$
$$Moles =Molaritet \ gange Liter$$
$$n =\frac{(13,3g/132,14 g/mol)}{0,1L}$$
$$n =0,1 \ mol/L$$
$$Moler \ af \ NH_4SO_4 \ i \ 12,00 \ mL =(0,1000 mol/L) \ gange (12,00 mL) =0,001200 \ mol$$
Trin 2:Beregn det totale volumen af opløsning efter tilsætning af 12,00 ml prøve.
Det samlede volumen er 57,00 mL + 12,00 mL =69,00 mL
Trin 3:Beregn den nye koncentration af ammoniumsulfat i den fortyndede opløsning.
Den nye koncentration kan beregnes ved hjælp af formlen:
$$M_1V_1 =M_2V_2$$
hvor M1 er den oprindelige koncentration, V1 er det oprindelige volumen, M2 er den nye koncentration, og V2 er det nye volumen.
$$(0,1000 mol/L) \ gange (100,0 mL) =M_2 \ gange (69,00 mL)$$
$$M_2 =\frac{(0,1000 mol/L) \ gange (100,0 mL)}{69,00 mL} =0,0725 mol/L$$
Derfor er den nye koncentration af ammoniumsulfat i den fortyndede opløsning 0,0725 mol/L.
 Varme artikler
Varme artikler
-
 Meget elastisk biologisk nedbrydelig hydrogel til bioprint af nyt vævYi Hong, UTA professor i bioteknik og leder af projektet. Kredit:UTA Forskere ved University of Texas i Arlington har udviklet en meget elastisk biologisk nedbrydelig hydrogel til bio-printning af
Meget elastisk biologisk nedbrydelig hydrogel til bioprint af nyt vævYi Hong, UTA professor i bioteknik og leder af projektet. Kredit:UTA Forskere ved University of Texas i Arlington har udviklet en meget elastisk biologisk nedbrydelig hydrogel til bio-printning af -
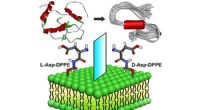 Nye fund kaster lys over udviklingen af liposom-baserede hæmmereMolekylær chiralitet medieret amyloiddannelse på phospholipidoverflader. Kredit:WANG Xue Alzheimers sygdom (AD) er en af de største globale folkesundhedsudfordringer. Imidlertid, patogenesen af
Nye fund kaster lys over udviklingen af liposom-baserede hæmmereMolekylær chiralitet medieret amyloiddannelse på phospholipidoverflader. Kredit:WANG Xue Alzheimers sygdom (AD) er en af de største globale folkesundhedsudfordringer. Imidlertid, patogenesen af -
 Ny udskrivningsproces fremmer 3-D-kapaciteterDette trækobjekt blev skabt ved hjælp af 3D-injektionsprint, en ny teknologi opfundet af UMass Lowell Plastics Engineering Prof. David Kazmer. Kredit:David Kazmer Mere holdbare proteser og medicin
Ny udskrivningsproces fremmer 3-D-kapaciteterDette trækobjekt blev skabt ved hjælp af 3D-injektionsprint, en ny teknologi opfundet af UMass Lowell Plastics Engineering Prof. David Kazmer. Kredit:David Kazmer Mere holdbare proteser og medicin -
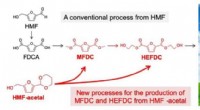 Grøn plastproduktion gjort letFigur 1. Reaktionsvej for produktion af MFDC og HEFDC fra HMF (en konventionel proces) og HMF-acetal (nye one-pot processer). Kredit:Kiyotaka Nakajima, Hokkaido Universitet En et-trins metode muli
Grøn plastproduktion gjort letFigur 1. Reaktionsvej for produktion af MFDC og HEFDC fra HMF (en konventionel proces) og HMF-acetal (nye one-pot processer). Kredit:Kiyotaka Nakajima, Hokkaido Universitet En et-trins metode muli
- Mobiltelefontilgængeligheden forbedres, men huller forbliver, undersøgelse finder
- University of California for at dumpe investeringer i fossilt brændstof
- Anvendelse af tørcellebatterier
- Forskere udvikler model, der justerer videospils sværhedsgrad baseret på spillerens følelser
- Aftalen indgået for at redde Londons røde busproducent:ejer
- Hvor godt forstår tyskerne vejrrisici?


