Hvorfor danner natrium- og kloratomer en ionbinding?
Når natrium- og kloratomer kommer i kontakt, tiltrækker det stærkt elektronegative kloratom kraftigt valenselektronen fra det mindre elektronegative natriumatom. Denne overførsel af elektroner resulterer i dannelsen af positivt ladede natriumioner (Na+) og negativt ladede chloridioner (Cl-).
Den elektrostatiske tiltrækning mellem de positivt ladede natriumioner og negativt ladede chloridioner holder den ioniske forbindelse sammen. Denne type binding, hvor elektroner overføres fra et atom til et andet, er kendt som en ionbinding.
I tilfælde af natriumchlorid (NaCl) er ionbindingen meget stærk på grund af den betydelige forskel i elektronegativitet mellem natrium- og kloratomer. Denne stærke ionbinding er ansvarlig for natriumchlorids karakteristiske egenskaber, såsom dets høje smelte- og kogepunkter, opløselighed i vand og evne til at lede elektricitet i smeltet tilstand eller når det er opløst i vand.
Sidste artikelBestår molekylære forbindelser af metaller eller ikke-metaller?
Næste artikelEr rent kalium metallisk eller kovalent?
 Varme artikler
Varme artikler
-
 Ny katalysator forvandler forurenende stoffer til brændstofHaotian Wang, hvem vil slutte sig til Rice fakultetet senere i år, er hovedforfatter til en undersøgelse, der skal omdanne kuldioxid til kulilte og andre industrielle brændstoffer. Kredit:Jon Chase/Ha
Ny katalysator forvandler forurenende stoffer til brændstofHaotian Wang, hvem vil slutte sig til Rice fakultetet senere i år, er hovedforfatter til en undersøgelse, der skal omdanne kuldioxid til kulilte og andre industrielle brændstoffer. Kredit:Jon Chase/Ha -
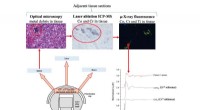 Undersøgelse af metalaflejring i organer efter ledudskiftningFigur 1:Oversigt over undersøgelsen. Kredit:Diamond Light Source Hofteprotesen anses for at være en af de mest vellykkede ortopædiske indgreb, med 75, 000 udført hvert år af NHS alene. Imidlerti
Undersøgelse af metalaflejring i organer efter ledudskiftningFigur 1:Oversigt over undersøgelsen. Kredit:Diamond Light Source Hofteprotesen anses for at være en af de mest vellykkede ortopædiske indgreb, med 75, 000 udført hvert år af NHS alene. Imidlerti -
 Nye superkondensatorer lagrer elektrisk ladning i tekstilmaterialerKredit:Asociacion RUVID Forskere fra Alcoi campus ved Valencias Polytekniske Universitet (UPV) har udviklet nye enheder, der lagrer elektrisk ladning i tekstilmaterialer, som kunne bruges til, for
Nye superkondensatorer lagrer elektrisk ladning i tekstilmaterialerKredit:Asociacion RUVID Forskere fra Alcoi campus ved Valencias Polytekniske Universitet (UPV) har udviklet nye enheder, der lagrer elektrisk ladning i tekstilmaterialer, som kunne bruges til, for -
 Kemikere ID mulig afhængighedsfri smertelindringKredit:CC0 Public Domain Anslået 1,7 millioner amerikanere lider af stofmisbrugslidelser relateret til opioidbrug til smertelindring, ifølge National Institute on Drug Abuse. Dette forårsager en ø
Kemikere ID mulig afhængighedsfri smertelindringKredit:CC0 Public Domain Anslået 1,7 millioner amerikanere lider af stofmisbrugslidelser relateret til opioidbrug til smertelindring, ifølge National Institute on Drug Abuse. Dette forårsager en ø
- De utilsigtede konsekvenser af oplagring:madspild
- COVID-19 presser universiteter til at skifte til onlinekurser - men er de klar?
- Fødevareindustriens affald bliver rentabel biogas
- Ny teknik forbinder multi-walled carbon nanorør
- Vand på Mars er ikke så udbredt som tidligere antaget, undersøgelse finder
- Hvordan man opbygger en armillær sphere


