Hvad er binære ioniske forbindelser lavet af?
* et metal (kation):Dette er den positivt ladede ion, der dannes, når et metalatom mister elektroner.
* en ikke -metal (anion):Dette er den negativt ladede ion, der dannes, når et ikke -metalatom får elektroner.
Nøglepunkter:
* modsatte afgifter tiltrækker: Den positivt ladede metalion og den negativt ladede ikke -metale ion tiltrækkes af hinanden på grund af elektrostatiske kræfter og danner en stærk ionisk binding.
* neutral forbindelse: Den samlede forbindelse skal være elektrisk neutral. Dette betyder, at antallet af positive ladninger fra metalkationen skal svare til antallet af negative ladninger fra den ikke -metalanion.
* faste forhold: Forholdet mellem metal og ikke -metale ioner i forbindelsen er fast, bestemt af ladningerne på ionerne.
Eksempler:
* NaCl (natriumchlorid): Natrium (NA) er et metal og danner en +1 -kation (Na +), mens klor (CL) er en ikke -metal og danner en -1 -anion (Cl-).
* mgo (magnesiumoxid): Magnesium (Mg) er et metal og danner en +2 -kation (Mg2 +), mens ilt (O) er en ikke -metal og danner en -2 -anion (O2-).
* KBR (kaliumbromid): Kalium (K) er et metal og danner en +1 -kation (K +), mens brom (BR) er en ikke -metal og danner en -1 -anion (Br-).
Vigtig note: Der er undtagelser fra disse regler, såsom forbindelser, der indeholder polyatomiske ioner (ioner lavet af flere atomer).
Sidste artikelHvilke 4 alkalimetaller er de mest reaktive?
Næste artikelHvorfor danner nitrogen NF3, men ikke SF6?
 Varme artikler
Varme artikler
-
 Kamæleonlignende materiale tilsat bor kommer tættere på at efterligne hjernecellerHvert vågent øjeblik, vores hjerne behandler en enorm mængde data for at give mening om omverdenen. Dermed, ved at efterligne den måde, den menneskelige hjerne løser hverdagens problemer, neuromorfe s
Kamæleonlignende materiale tilsat bor kommer tættere på at efterligne hjernecellerHvert vågent øjeblik, vores hjerne behandler en enorm mængde data for at give mening om omverdenen. Dermed, ved at efterligne den måde, den menneskelige hjerne løser hverdagens problemer, neuromorfe s -
 Partikelfasekemi gør det muligt for sod at spire skyer bedreMeget oxygenerede organiske molekyler med høj umættethed (HU-HOMer) dannes ved multigenerationel fotooxidation af store polycykliske aromatiske kulbrinter (PAHer) på sod. Kredit:Chem Meget oxygene
Partikelfasekemi gør det muligt for sod at spire skyer bedreMeget oxygenerede organiske molekyler med høj umættethed (HU-HOMer) dannes ved multigenerationel fotooxidation af store polycykliske aromatiske kulbrinter (PAHer) på sod. Kredit:Chem Meget oxygene -
 Forskere finder, at nogle ciderproducenter tilføjer unødvendigt sukkerKredit:CC0 Public Domain Det er feriesæsonen og den tid på året, hvor der er masser af libations ved næsten enhver begivenhed og eller fest. Imidlertid, du er muligvis ikke opmærksom på alle ingre
Forskere finder, at nogle ciderproducenter tilføjer unødvendigt sukkerKredit:CC0 Public Domain Det er feriesæsonen og den tid på året, hvor der er masser af libations ved næsten enhver begivenhed og eller fest. Imidlertid, du er muligvis ikke opmærksom på alle ingre -
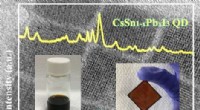 Forskere rapporterer om fasestabil uorganisk halogenidperovskitStabil CsSn 1-x PbxI 3 perovskit nanokrystaller. Kredit:University of Electro Communications CsSnI 3 er en prototype af uorganisk halogenidperovskit, der for nylig er blevet foreslået som en
Forskere rapporterer om fasestabil uorganisk halogenidperovskitStabil CsSn 1-x PbxI 3 perovskit nanokrystaller. Kredit:University of Electro Communications CsSnI 3 er en prototype af uorganisk halogenidperovskit, der for nylig er blevet foreslået som en
- Kan vi genoplive thylacinen? Måske, men det hjælper ikke den globale udryddelseskrise
- Daimler skærer ned på prognosen for 2019 efter tab i 2. kvartal
- Hvad er forskelle i vulkaner?
- Hvordan partisk had får folk til at tro på usandheder
- Sådan udjævner du et sammenrullet magnetisk skilt
- Islinser kan forårsage mange arktiske jordskred


