Hvis 0,320 mol zink reagerer med overskydende bly (IV) sulfat, hvor mange gram der vil blive produceret i den følgende reaktion?
1. Skriv den afbalancerede kemiske ligning:
Zn (s) + 2pb (SO₄) ₂ (aq) → Zn (SO₄) ₂ (aq) + 2pbso₄ (s)
2. Bestem molforholdet:
Den afbalancerede ligning viser, at 1 mol zink (Zn) reagerer på at producere 2 mol bly (II) sulfat (PBSO₄).
3. Beregn molen af bly (II) sulfat produceret:
Da vi har 0,320 mol zink, og molforholdet er 1:2, vil vi producere:
0,320 mol Zn * (2 mol pbso₄ / 1 mol Zn) =0,640 mol PBSO₄
4. Beregn massen af bly (ii) sulfat produceret:
For at konvertere mol PBSO₄ til gram har vi brug for den molære masse af PBSO₄:
* PB:207,2 g/mol
* S:32,06 g/mol
* O:16,00 g/mol (x 4)
Molmasse PBSO₄ =207,2 + 32,06 + (16,00 * 4) =303,26 g/mol
Beregn nu massen:
0,640 mol pbso₄ * (303,26 g pbso₄ / 1 mol pbso₄) = 194,1 g pbso₄
Derfor ville 194,1 gram bly (II) sulfat blive produceret.
 Varme artikler
Varme artikler
-
 Li-ioner transporterer på tværs af elektrolytter og SEIKredit:CC0 Public Domain Li-ion-transportens kinetik på tværs af elektrolytten og SEI er sædvanligvis det hastighedsbestemmende trin i Li-plettering-stripningsprocessen. Før galvanisering på anode
Li-ioner transporterer på tværs af elektrolytter og SEIKredit:CC0 Public Domain Li-ion-transportens kinetik på tværs af elektrolytten og SEI er sædvanligvis det hastighedsbestemmende trin i Li-plettering-stripningsprocessen. Før galvanisering på anode -
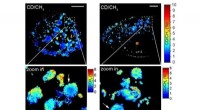 Forskere forstørrer skjulte biologiske strukturer ved at kombinere SRS og ekspansionsmikroskopiMAGNIFIERS fangede nyligt syntetiserede Huntingtin-aggregater (i rødt) med opløsning i nanoskala i Huntington-sygdomsmodellen. Kredit:Carnegie Mellon University Et forskerhold fra Carnegie Mellon U
Forskere forstørrer skjulte biologiske strukturer ved at kombinere SRS og ekspansionsmikroskopiMAGNIFIERS fangede nyligt syntetiserede Huntingtin-aggregater (i rødt) med opløsning i nanoskala i Huntington-sygdomsmodellen. Kredit:Carnegie Mellon University Et forskerhold fra Carnegie Mellon U -
 Parfumemagere søger naturligt, bæredygtige dufteKredit:CC0 Public Domain I 1921, parfumeur Ernest Beaux opdagede, at tilføjelse af syntetiske aldehyder til naturlige rose- og jasmindufte producerede den helt rigtige duftkombination til den ikon
Parfumemagere søger naturligt, bæredygtige dufteKredit:CC0 Public Domain I 1921, parfumeur Ernest Beaux opdagede, at tilføjelse af syntetiske aldehyder til naturlige rose- og jasmindufte producerede den helt rigtige duftkombination til den ikon -
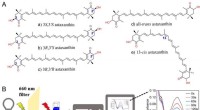 Evaluering af antioxidantaktiviteter af astaxanthinisomerer mod singlet oxygenA. Strukturer af stereoisomerer af astaxanthin; B. Måling af singlet-iltslukningskapaciteten af antioxidanter. Kredit:Zheng Xinxin Forskere ledet af prof. Huang Qing fra Hefei Institutes of Physi
Evaluering af antioxidantaktiviteter af astaxanthinisomerer mod singlet oxygenA. Strukturer af stereoisomerer af astaxanthin; B. Måling af singlet-iltslukningskapaciteten af antioxidanter. Kredit:Zheng Xinxin Forskere ledet af prof. Huang Qing fra Hefei Institutes of Physi
- Fysikere forklarer, hvordan en type nordlys på Mars dannes
- Flintvandskrise er det mest forfærdelige eksempel på miljømæssig uretfærdighed, siger forsker
- Hvilket land er 80 grader syd 140 øst?
- Superkritisk kuldioxid leverer beskyttende molekyler til halvlederoverflader
- En verdens første inden for cirkadisk urmanipulation
- Mørk materie halvdelen af, hvad vi troede, siger videnskabsmænd


