Hvorfor er hydrogenioner, der er tilskrives til vandmolekyler?
1. Polaritet af vand: Vandmolekyler er polære, hvilket betyder, at de har en lidt positiv ladning på den ene side (nær hydrogenatomerne) og en lidt negativ ladning på den anden side (nær iltatomet).
2. Elektrostatisk interaktion: Den positivt ladede hydrogenion (H+) tiltrækkes stærkt af det negativt ladede iltatom i vandmolekylet. Denne elektrostatiske interaktion danner en stærk binding mellem de to.
3. Hydrogenbinding: Vandmolekyler kan danne hydrogenbindinger med hinanden, og disse bindinger dannes også let med brintioner. En hydrogenbinding er en speciel type dipol-dipolinteraktion, hvor et hydrogenatom er kovalent forbundet med et stærkt elektronegativt atom (som ilt) og tiltrækkes af et andet stærkt elektronegativt atom.
4. Hydratiseringsskal: Når en hydrogenion kommer ind i vandet, er den omgivet af flere vandmolekyler og danner en hydratiseringsskal. Vandmolekylerne i denne skal orienterer sig med deres negative poler mod den positive hydrogenion, hvilket yderligere stabiliserer dens tilstedeværelse i opløsningen.
5. Høj dielektrisk konstant af vand: Vand har en høj dielektrisk konstant, hvilket betyder, at det effektivt kan svække de elektrostatiske kræfter mellem ladede partikler. Dette hjælper med at stabilisere hydrogenionen i opløsningen yderligere ved at reducere tiltrækningen mellem den og andre positive ioner.
Sammenfattende skyldes tiltrækningen mellem brintioner og vandmolekyler en kombination af elektrostatiske kræfter, brintbinding og de unikke egenskaber ved vand. Denne attraktion er afgørende for mange biologiske og kemiske processer, herunder syre-base-reaktioner, proteinfoldning og transport af ioner på tværs af cellemembraner.
Sidste artikelEr CLF4- polær eller ikke polær?
Næste artikelHvorfor bruges silicageler i kromatografi?
 Varme artikler
Varme artikler
-
 Hvorfor en sprækkelig skorpe er afgørende for en baguettes aroma og smagKredit:American Chemical Society En autentisk fransk baguette er en af de vigtigste råvarer, som foodies jagter efter. Nu har forskere fået ny indsigt i, hvorfor en sprød skorpe er et must til d
Hvorfor en sprækkelig skorpe er afgørende for en baguettes aroma og smagKredit:American Chemical Society En autentisk fransk baguette er en af de vigtigste råvarer, som foodies jagter efter. Nu har forskere fået ny indsigt i, hvorfor en sprød skorpe er et must til d -
 Forskere opdager vejen til at forbedre spilskiftende batterielektrodeElbilproducenter er intenst interesserede i lithium-rige batterikatoder, der kan øge rækkevidden betydeligt. En ny undersøgelse åbner en vej til at få dem til at leve op til deres løfte. Kredit:Stanfo
Forskere opdager vejen til at forbedre spilskiftende batterielektrodeElbilproducenter er intenst interesserede i lithium-rige batterikatoder, der kan øge rækkevidden betydeligt. En ny undersøgelse åbner en vej til at få dem til at leve op til deres løfte. Kredit:Stanfo -
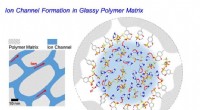 Vil stærk og hurtigt skiftende kunstig muskel være mulig?Skematisk diagram af ionkanaldannelse inde i polymerelektrolytten. Kredit:POSTECH I den amerikanske actionfilm Pacific Rim kæmper gigantiske robotter kaldet Jaegers mod ukendte monstre for at redde
Vil stærk og hurtigt skiftende kunstig muskel være mulig?Skematisk diagram af ionkanaldannelse inde i polymerelektrolytten. Kredit:POSTECH I den amerikanske actionfilm Pacific Rim kæmper gigantiske robotter kaldet Jaegers mod ukendte monstre for at redde -
 Den amerikanske gigant Monsanto kendt for kontroversielle kemikalierDet Internationale Agentur for Kræftforskning, en del af FNs Verdenssundhedsorganisation, klassificerede i 2015 Roundups hovedingrediens glyphosat som et sandsynligt kræftfremkaldende stof Fra Age
Den amerikanske gigant Monsanto kendt for kontroversielle kemikalierDet Internationale Agentur for Kræftforskning, en del af FNs Verdenssundhedsorganisation, klassificerede i 2015 Roundups hovedingrediens glyphosat som et sandsynligt kræftfremkaldende stof Fra Age
- Ny kortlægningsmetode belyser medicinbare steder på proteiner
- Barrierer og muligheder i produktionen af vedvarende biobrændstoffer
- Ionstråler og atomknusere:månestens hemmeligheder
- En guide til plantning af træer til miljøretfærdighed
- Forskere opdager, hvordan myg undgår at bukke under for vira, de overfører
- Hvorfor kan et fly flyve i rummet?


