Hvordan finder du et antal uparrede elektroner?
1. Elektronkonfiguration:
* Skriv elektronkonfigurationen: Start med at skrive den fulde elektronkonfiguration for atom eller ion. For eksempel er elektronkonfigurationen af ilt (O) 1S² 2S² 2P⁴.
* Fyld orbitaler Diagrammatisk: Brug Hunds regel og Aufbau -princippet til at udfylde orbitaler i et diagram. Dette vil hjælpe dig med at visualisere elektronarrangementet. For eksempel til Oxygen's 2p underskal:
* _ _ _
* ↑ ↓ ↑ ↑
* Tæl de uparrede elektroner: I diagrammet er de uparrede elektroner dem, der besætter orbitaler af sig selv. Oxygen har to uparrede elektroner i sit 2p -underskal.
2. Brug af den periodiske tabel:
* Identificer elementets gruppe: Gruppenummeret (ekskl. Overgangsmetaller) fortæller dig antallet af valenselektroner.
* Overvej elementets position: Hvis elementet er i de to første kolonner eller de sidste seks kolonner i den periodiske tabel (ekskl. Overgangsmetaller), kan antallet af uparrede elektroner let bestemmes:
* Grupper 1 og 2:De har henholdsvis 1 og 2 uparrede elektroner.
* Grupper 13-18:
* Grupper 13 og 14 har henholdsvis 3 og 2 uparrede elektroner.
* Grupper 15-18 har henholdsvis 3, 2, 1 og 0 uparrede elektroner.
* overgangsmetaller er mere komplekse: Du skal bruge elektronkonfiguration og orbitaldiagrammer til overgangsmetaller.
Eksempel:Nitrogen (n)
1. Elektronkonfiguration: 1S² 2S² 2P³
2. orbital diagram:
* _ _ _
* ↑ ↑ ↑
3. uparrede elektroner: Nitrogen har tre uparrede elektroner.
Nøglepunkter:
* Hunds regel: Elektroner udfylder orbitaler individuelt, inden de parrer sig inden for det samme underskal.
* aufbau -princip: Elektroner udfylder orbitaler i rækkefølge af stigende energi.
* paramagnetisme: Atomer med uparrede elektroner er paramagnetiske, hvilket betyder, at de tiltrækkes af et magnetfelt.
* diamagnetisme: Atomer med alle parrede elektroner er diamagnetiske, hvilket betyder, at de svagt afvises af et magnetisk felt.
Fortæl mig, hvis du vil arbejde gennem et specifikt eksempel!
 Varme artikler
Varme artikler
-
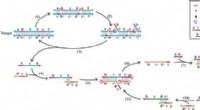 Let kopiering:En universel isoterm DNA -amplifikationsmetodeKredit:Wiley Uanset om man afslører en gerningsmand med DNA -bevis, diagnosticering af et patogen, klassificering af en paleontologisk opdagelse, eller bestemme faderskab, dobbeltarbejde af nuklei
Let kopiering:En universel isoterm DNA -amplifikationsmetodeKredit:Wiley Uanset om man afslører en gerningsmand med DNA -bevis, diagnosticering af et patogen, klassificering af en paleontologisk opdagelse, eller bestemme faderskab, dobbeltarbejde af nuklei -
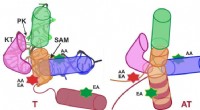 Hvordan molekylære riboswitches virker i bakterierSkematisk repræsentation af SAM-I riboswitchen i terminatorkonformationen (sluk; venstre) og antiterminatorkonformationen (switch til; højre). Kredit:Grafik:APH/KIT Mange bakterier har molekylære
Hvordan molekylære riboswitches virker i bakterierSkematisk repræsentation af SAM-I riboswitchen i terminatorkonformationen (sluk; venstre) og antiterminatorkonformationen (switch til; højre). Kredit:Grafik:APH/KIT Mange bakterier har molekylære -
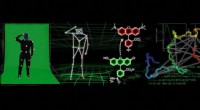 Kemikere udvikler motion capture-lignende teknologi til sporing af proteinformKredit:University of Pennsylvania I mange moderne animationsfilm, tricket til at opnå realistiske bevægelser for individuelle karakterer og objekter ligger i motion-capture teknologi. Denne proces
Kemikere udvikler motion capture-lignende teknologi til sporing af proteinformKredit:University of Pennsylvania I mange moderne animationsfilm, tricket til at opnå realistiske bevægelser for individuelle karakterer og objekter ligger i motion-capture teknologi. Denne proces -
 Maskinlæring tilbyder en ny måde at designe kirale krystaller påFor at bygge en chiral magnet (billedet), det er nødvendigt først at designe en chiral krystal. Kredit:Julien Zaccaro / Center for Chiral Science Ingeniører og kemikere ved Hiroshima University ha
Maskinlæring tilbyder en ny måde at designe kirale krystaller påFor at bygge en chiral magnet (billedet), det er nødvendigt først at designe en chiral krystal. Kredit:Julien Zaccaro / Center for Chiral Science Ingeniører og kemikere ved Hiroshima University ha
- UFO -hændelsen på Maury Island
- Hvordan man fortæller en mand fra en kvindelig hånende fugl
- PlayStation VR roundup:Stardust Odyssey, Audica fremhæver ferietilbud
- Fødevarekæden og fisken
- Californien overvejer, hvordan man regulerer førerløse biler (Opdatering 2)
- Ny metode forudsiger høststed for at afsløre ulovlig træeksport


