Hvor mange valenselektron ilt har?
Her er hvorfor:
* Elektronkonfiguration: Oxygen's elektronkonfiguration er 1S² 2S²2P⁴.
* Valence Shell: Den yderste skal (den 2. skal i dette tilfælde) kaldes valensskallen.
* Valenselektroner: Elektronerne i valensskallen kaldes valenselektroner. I Oxygen's tilfælde er der 2 elektroner i 2S -underskalet og 4 elektroner i underskalet 2p, hvilket giver i alt 6 valenselektroner.
Sidste artikelHvordan relaterer ioner og valenselektroner?
Næste artikelHvor mange mol vand (dihydrogenoxid) er til stede i 75 gram?
 Varme artikler
Varme artikler
-
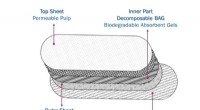 Sikrere hygiejnebind lavet af palmestivelseSkematisk af det fremstillede biologisk nedbrydelige hygiejnebind. Kredit:International Islamic University Malaysia Et biologisk nedbrydeligt hygiejnebind lavet af sagostivelse kunne bidrage til i
Sikrere hygiejnebind lavet af palmestivelseSkematisk af det fremstillede biologisk nedbrydelige hygiejnebind. Kredit:International Islamic University Malaysia Et biologisk nedbrydeligt hygiejnebind lavet af sagostivelse kunne bidrage til i -
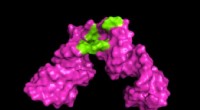 Forskere udvikler værktøjer til at skærpe 3D-visning af store RNA-molekylerUniversity of Maryland forskere udviklede en metode til at udvide omfanget af nuklear magnetisk resonans (NMR) spektroskopi. I eksemplet ovenfor, forskerne var i stand til at skabe et 3D-billede, der
Forskere udvikler værktøjer til at skærpe 3D-visning af store RNA-molekylerUniversity of Maryland forskere udviklede en metode til at udvide omfanget af nuklear magnetisk resonans (NMR) spektroskopi. I eksemplet ovenfor, forskerne var i stand til at skabe et 3D-billede, der -
 Minimering af brændstofeksplosioner og brande fra ulykker og terrorhandlinger med polymererNye polymerbrændstofadditiver er bedre til at reducere eksplosive brande (nederst) end konventionelle additiver (øverst). Kredit:Julia Kornfield Når en terrorhandling eller et køretøj eller en ind
Minimering af brændstofeksplosioner og brande fra ulykker og terrorhandlinger med polymererNye polymerbrændstofadditiver er bedre til at reducere eksplosive brande (nederst) end konventionelle additiver (øverst). Kredit:Julia Kornfield Når en terrorhandling eller et køretøj eller en ind -
 Forskere observerer katalysator under Fischer-Tropsch-syntese for første gangTestopsætning inklusive højtrykscelle til Fischer-Tropsch-målingskampagnen ved hjælp af CAT-ACT-målelinjen ved KIT-synkrotronen. Kredit:Tiziana Carambia Egnede katalysatorer er af stor betydning f
Forskere observerer katalysator under Fischer-Tropsch-syntese for første gangTestopsætning inklusive højtrykscelle til Fischer-Tropsch-målingskampagnen ved hjælp af CAT-ACT-målelinjen ved KIT-synkrotronen. Kredit:Tiziana Carambia Egnede katalysatorer er af stor betydning f
- Nyt værktøj tackler reproducerbarhedskrisen i videnskaben
- Hvad ville være mere frugtbar jord på bakket land eller en slette?
- Offentligheden – og forskere – er skeptiske over for klimateknik
- Små og mellemstore byer er overraskende innovative
- Turende strukturer i et menneskeskabt interface
- Forsker sporer præcist bevægelser af en enkelt katalysatorpartikel


