Hvad beskriver Electron Orbital?
Her er en sammenbrud:
* bølgepartikel dualitet: Elektroner udviser både bølge- og partikelegenskaber. Deres bølgekarakter er beskrevet af en bølgefunktion, der dikterer sandsynligheden for at finde elektronet på et specifikt sted.
* Sandsynlighedsfordeling: En elektron orbital repræsenterer en region, hvor der er stor sandsynlighed for at finde elektronet. Det er ikke en solid, defineret grænse.
* form og energi: Orbitaler har forskellige former (S, P, D, F) og energiniveau. Formen afspejler fordelingen af elektronens bølgefunktion i rummet, og energiniveauet bestemmer dens energi.
* kvantetal: Hver orbital er defineret af et sæt med fire kvantetal (n, l, m l , m s ) der beskriver elektronens energi, form, rumlig orientering og spin.
I det væsentlige er en elektron -orbital en model, der hjælper os med at forstå opførsel af elektroner inden for et atom, selvom vi ikke præcist kan spore deres bevægelser.
Her er en analogi:Forestil dig, at du har en flimrende lyspære. Du kan ikke se lyspartiklerne (fotoner) selv, men du kan observere lysets intensitet og de områder, det lyser. Tilsvarende kan vi ikke se elektroner, men vi kan bruge orbitaler til at forstå deres sandsynlige placering og energiniveau.
Sidste artikelHvilke subatomære partikler sammensætter massen af et atom?
Næste artikelHvilke subatomære partikler har en afgift?
 Varme artikler
Varme artikler
-
 Oprettelse af strækbare termoelektriske generatorerNara Kim og i baggrunden Xavier Crispin og Klas Tybrandt, Laboratorium for organisk elektronik, Linköpings Universitet. Kredit:Thor Balkhed For første gang, der er skabt et blødt og strækbart orga
Oprettelse af strækbare termoelektriske generatorerNara Kim og i baggrunden Xavier Crispin og Klas Tybrandt, Laboratorium for organisk elektronik, Linköpings Universitet. Kredit:Thor Balkhed For første gang, der er skabt et blødt og strækbart orga -
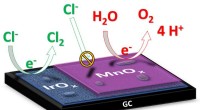 Et skridt nærmere bæredygtig energi fra havvandUnder elektrolyse af vand, elektricitet ledes gennem vandet for at spalte det i andre stoffer. I den ønskede reaktion, flydende vand (H2O) spaltes i oxygengas (O2) og brintgas (H2). I saltvand, natriu
Et skridt nærmere bæredygtig energi fra havvandUnder elektrolyse af vand, elektricitet ledes gennem vandet for at spalte det i andre stoffer. I den ønskede reaktion, flydende vand (H2O) spaltes i oxygengas (O2) og brintgas (H2). I saltvand, natriu -
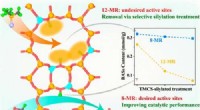 Ny strategi til at kontrollere fordelingen af syresteder i zeolitterGrafisk abstrakt. Kredit:ACS Catalysis (2022). DOI:10.1021/acscatal.1c05896 Zeolitter er en af de formselektive katalysatorer. Zeolitternes egenskaber, som kommer fra den strukturelle indeslutnin
Ny strategi til at kontrollere fordelingen af syresteder i zeolitterGrafisk abstrakt. Kredit:ACS Catalysis (2022). DOI:10.1021/acscatal.1c05896 Zeolitter er en af de formselektive katalysatorer. Zeolitternes egenskaber, som kommer fra den strukturelle indeslutnin -
 Video:Popping balloner med stilKredit:The American Chemical Society Appelsinskræller indeholder limonen, og dette kemikalie er nøglen til et festtrick, hvor du kan springe en ballon med et twist. Limonene er et usædvanligt god
Video:Popping balloner med stilKredit:The American Chemical Society Appelsinskræller indeholder limonen, og dette kemikalie er nøglen til et festtrick, hvor du kan springe en ballon med et twist. Limonene er et usædvanligt god
- Metan -cykling i vådområde steg under gammel global opvarmning
- Det mærkelige tilfælde af OpenBazaar
- Hvad sker der med ioniske og kovalente forbindelser, når de opløses i vand?
- Hvordan og solbruner virker
- Sådan beregnes forbrændingsvarmen af paraffinvoks
- Skræddersyet hærdning af bulk metallisk glas induceret af 2-D gradientforyngelse


