Hvad menes med som i opløselighedsretningslinjen opløses som?
Stoffer med lignende polariteter opløses i hinanden.
Her er en sammenbrud:
* Polaritet: Dette henviser til fordelingen af elektrisk ladning inden for et molekyle. Polære molekyler har en ujævn fordeling af ladning, hvilket skaber en positiv og en negativ ende (som en magnet). Ikke -polære molekyler har en jævn fordeling af ladning.
* opløste: Dette betyder, at et stof (opløsningen) er jævnt spredt inden for et andet (opløsningsmidlet).
hvordan det fungerer:
* polære opløsningsmidler Opløs polære opløste stoffer: Forestil dig et polært opløsningsmiddel som vand. Den positive ende af et vandmolekyle vil blive tiltrukket af den negative ende af et polært opløst molekyle, mens den negative ende af vandmolekylet vil blive tiltrukket af den positive ende af opløsningen. Denne attraktion gør det muligt for de opløste molekyler at gå i stykker og spredes inden for opløsningsmidlet.
* ikke -polære opløsningsmidler Opløs ikke -polære opløste stoffer: Ikke -polære opløsningsmidler som olie har ingen forskellige positive eller negative mål. Ikke -polære opløste stoffer mangler også stærke positive eller negative afgifter. På grund af dette kan de interagere med hinanden gennem svage kræfter kaldet London Dispersion Forces. Disse kræfter er tilstrækkelige til, at det ikke -polære opløste stof opløses i det ikke -polære opløsningsmiddel.
* polære og ikke -polære stoffer blandes ikke: Den stærke tiltrækning mellem polære molekyler (som vand) og den svage tiltrækning mellem ikke -polære molekyler (som olie) forhindrer dem i at blande. Dette er grunden til, at olie og vand ikke blandes.
Eksempler:
* vand (polær) opløser salt (polær): De positive ioner i salt tiltrækkes af den negative ende af vandmolekylerne, og de negative ioner i salt tiltrækkes af den positive ende af vandmolekylerne.
* olie (ikke -polær) opløser fedt (ikke -polær): Både olie og fedt er ikke -polære, så de kan interagere gennem svage London -spredningskræfter.
* vand (polær) opløser ikke olie (ikke -polær): De stærke attraktioner mellem vandmolekyler er meget stærkere end de svage attraktioner mellem olie- og vandmolekyler.
Vigtige noter:
* Reglen "som opløser som" er en generel retningslinje og har undtagelser.
* Styrken af interaktionerne mellem molekyler er vigtig. Selv hvis to molekyler har lignende polariteter, hvis tiltrækningen mellem dem ikke er stærk nok, opløses de muligvis ikke.
Generelt kan det at forstå begrebet polaritet og "som opløser som" regel hjælpe dig med at forudsige opløseligheden af stoffer og træffe mere informerede beslutninger inden for kemi.
 Varme artikler
Varme artikler
-
 Ny deaktiveringsmekanisme for switchproteiner fundetKlaus Gerwert, Till Rudack og Carsten Kötting (fra venstre) har undersøgt switch -proteiner i årevis, for eksempel Ras -proteinet afbildet her. Kredit:RUB En ny mekanisme til deaktivering af switc
Ny deaktiveringsmekanisme for switchproteiner fundetKlaus Gerwert, Till Rudack og Carsten Kötting (fra venstre) har undersøgt switch -proteiner i årevis, for eksempel Ras -proteinet afbildet her. Kredit:RUB En ny mekanisme til deaktivering af switc -
 Undersøgelse af oxidative veje i atombrændstofDet radiokemiske behandlingslaboratorium på PNNL er hjemsted for et JEOL GrandARM-300F scanningstransmissionselektronmikroskop, her drives af materialeforsker Steven Spurgeon. Denne specialiserede fac
Undersøgelse af oxidative veje i atombrændstofDet radiokemiske behandlingslaboratorium på PNNL er hjemsted for et JEOL GrandARM-300F scanningstransmissionselektronmikroskop, her drives af materialeforsker Steven Spurgeon. Denne specialiserede fac -
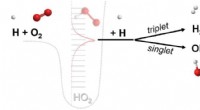 Forskere opdager en ny klasse af kemisk reaktionEn kemisk reaktion, hvor tre forskellige molekyler (fx H, O2, H) hver deltager i brydning og dannelse af kemiske bindinger. Reaktionen medieres af et flygtig kollisionskompleks (HO2**) dannet ved samm
Forskere opdager en ny klasse af kemisk reaktionEn kemisk reaktion, hvor tre forskellige molekyler (fx H, O2, H) hver deltager i brydning og dannelse af kemiske bindinger. Reaktionen medieres af et flygtig kollisionskompleks (HO2**) dannet ved samm -
 Ny STM -teknik peger på nye og renere lægemidlerMikroskopbilleder af bindingerne skrider frem i klarhed. Kredit:University of Warwick Et forskningsprojekt ledet af kemikere ved University of Warwick brugte først tunnelmikroskopi med ultrahøj op
Ny STM -teknik peger på nye og renere lægemidlerMikroskopbilleder af bindingerne skrider frem i klarhed. Kredit:University of Warwick Et forskningsprojekt ledet af kemikere ved University of Warwick brugte først tunnelmikroskopi med ultrahøj op
- Hvad er den forudsagte generelle formel for sammensat dannet mellem et alkalimetal og svovl?
- 1 ud af 3 amerikanere er nu 'alarmerede' over klimaændringer. Hvorfor er vores ledere ikke det?
- Hvor tung eller tæt en klippe er det, den kaldte?
- Undersøgelse viser, at folk er mere tilfredse efter at have forladt status quo
- Hvordan påvirker mitose livet?
- Sådan får du en større hjerne


