Kan enhver atomform type binding?
* Elektronegativitet: Atomer har forskellige elektronegativiteter, som er deres tendens til at tiltrække elektroner. Denne forskel driver dannelsen af forskellige typer obligationer.
* Valenselektroner: Antallet af valenselektroner (elektroner i den yderste skal) bestemmer, hvor mange bindinger et atom der kan dannes.
* Bindingspræferencer: Nogle atomer har en stærk præference for at danne specifikke typer bindinger på grund af deres elektroniske struktur og reaktivitet.
Her er en sammenbrud af de vigtigste typer obligationer og de faktorer, der påvirker dem:
1. Ioniske bindinger:
* dannelse: Forekommer mellem et metal (lav elektronegativitet) og en ikke -metal (høj elektronegativitet). Metalatomet mister elektroner til dannelse af en positivt ladet ion (kation), mens ikke -metalatomet får elektroner til at danne en negativt ladet ion (anion). Den elektrostatiske tiltrækning mellem disse modsatte ladede ioner danner bindingen.
* Eksempel: Natrium (NA) og chlor (CL) danner en ionisk binding til fremstilling af natriumchlorid (NaCl) eller bordsalt.
2. Kovalente obligationer:
* dannelse: Forekommer mellem to ikke -metaller (lignende elektronegativitet), hvor de deler elektroner.
* Typer:
* ikke -polære kovalente obligationer: Elektroner deles lige mellem atomerne. Dette sker, når elektronegativitetsforskellen er meget lille.
* polære kovalente obligationer: Elektroner deles ulige mellem atomerne på grund af en forskel i elektronegativitet. Dette skaber en delvis positiv ladning på det ene atom og en delvis negativ ladning på den anden.
* Eksempel: To kloratomer (CL) danner en ikke -polær kovalent binding i et klormolekyle (CL2). Oxygen og brint danner en polær kovalent binding i et vandmolekyle (H2O).
3. Metalliske bindinger:
* dannelse: Forekommer mellem metalatomer. Valenselektronerne delokaliseres og bevæger sig frit gennem metalgitteret. Denne frie bevægelse af elektroner skaber stærke attraktive kræfter mellem metalatomerne.
* Eksempel: Kobber (Cu) atomer danner en metallisk binding i en kobbertråd.
4. Hydrogenbindinger:
* dannelse: En speciel type intermolekylær kraft mellem et hydrogenatom kovalent bundet til et stærkt elektronegativt atom (som ilt eller nitrogen) og et andet elektronegativt atom.
* Eksempel: Vandmolekyler danner hydrogenbindinger med hinanden.
Kortfattet:
* Ikke hvert atom kan danne enhver type binding.
* Den dannede bindingstype afhænger af elektronegativitetsforskellen mellem de involverede atomer, antallet af valenselektroner og atomernes specifikke bindingspræferencer.
Sidste artikelHvordan hjælper salt vand med at koge?
Næste artikelHvad er vandtæt legering lavet af?
 Varme artikler
Varme artikler
-
 Kemikere bruger elektrokemi til at forstærke lægemiddelproduktionenPostdoc Niankai Fu, hovedforfatter til Science -papiret. Kredit:Cornell University Giv din medicin et stød. Ved at bruge - elektrokemi - en teknik, der kombinerer elektricitet og kemi, fremtidige
Kemikere bruger elektrokemi til at forstærke lægemiddelproduktionenPostdoc Niankai Fu, hovedforfatter til Science -papiret. Kredit:Cornell University Giv din medicin et stød. Ved at bruge - elektrokemi - en teknik, der kombinerer elektricitet og kemi, fremtidige -
 Udforskning af fordelene ved defekter i laserfremstillede materialerKredit:CC0 Public Domain Metal additive manufacturing (AM) lover at revolutionere den måde, vi producerer og bruger visse dele på. Reducering af materialespild og arbejdstid, metal AM forenkler tr
Udforskning af fordelene ved defekter i laserfremstillede materialerKredit:CC0 Public Domain Metal additive manufacturing (AM) lover at revolutionere den måde, vi producerer og bruger visse dele på. Reducering af materialespild og arbejdstid, metal AM forenkler tr -
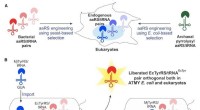 Konstrueret genetisk maskineri afledt af E. coli leverer nye aminosyrer til proteinerBoston College kemikere har udviklet en ny, bakterie-afledt teknologi til at inkorporere ikke-kanoniske aminosyrer i proteiner fra en bred klasse af organismer, inklusive mennesker. Kredit:Cell Chemic
Konstrueret genetisk maskineri afledt af E. coli leverer nye aminosyrer til proteinerBoston College kemikere har udviklet en ny, bakterie-afledt teknologi til at inkorporere ikke-kanoniske aminosyrer i proteiner fra en bred klasse af organismer, inklusive mennesker. Kredit:Cell Chemic -
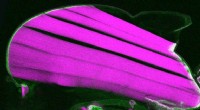 Hvordan holder muskel- og seneforbindelser hele livet?Skær i længderetningen gennem thoraxen på en frugtflue med en indsat kraftsensor i talinproteinet. Kraftsensoren på muskel-seneforbindelserne er grøn, og flyvemusklerne er magenta. Kredit:S. Lemke et
Hvordan holder muskel- og seneforbindelser hele livet?Skær i længderetningen gennem thoraxen på en frugtflue med en indsat kraftsensor i talinproteinet. Kraftsensoren på muskel-seneforbindelserne er grøn, og flyvemusklerne er magenta. Kredit:S. Lemke et
- Det forværrede Great Barrier Reef stilles:Unge fisk hører ikke længere deres vej hjem
- Hvilken konstant kraft giver en masse på 9,5 kg og acceleration 10 mil i sekundet?
- Varmt nyt materiale kan holde elektronik cool:Få atomlag af grafen afslører unikke termiske egensk…
- Forskere antyder, at Lillefod er en helt ny art af tidlige mennesker
- Elektrodedesign baner vej for bedre biobrændselsceller, elektrokemiske enheder
- Det er matematisk umuligt at slå aldring, siger videnskabsmænd


