Hvorfor magnesium har lavere smelte- og kogepunkt end calciumstrontium Andre medlemmer, der er til stede nedenfor Magnesium?
Metallisk binding og effektiv nuklear ladning
* Metallisk binding: Metaller holdes sammen af et "hav" af delokaliserede elektroner. Styrken ved denne metalliske binding bestemmes af tiltrækningen mellem de positivt ladede metalioner og det negativt ladede elektronhav.
* Effektiv nuklearafgift (ZEFF): Den effektive atomafgift er den nettopositive ladning, der opleves af et elektron i et atom. Det er påvirket af antallet af protoner i kernen (atomnummer) og afskærmningseffekten af indre elektroner.
Forklaring på Magnesiums lavere smelte- og kogepunkt:
1. mindre atomradius: Magnesium har en mindre atomradius end calcium, strontium og elementerne nedenfor. Dette betyder, at dens valenselektroner er tættere på kernen.
2. svagere metallisk binding: Den mindre atomradius af magnesium resulterer i svagere metallisk binding af følgende grunde:
* reduceret elektron -delokalisering: Valenselektroner i magnesium holdes mere tæt af kernen, hvilket gør dem mindre let delokaliseret.
* lavere elektrondensitet: Med mindre atomer er elektrondensiteten i det metalliske hav lavere, hvilket fører til svagere elektrostatisk tiltrækning mellem de positive ioner og elektronerne.
3. lavere effektiv nuklearafgift: Selvom magnesium har et højere atomnummer end beryllium, er dets valenselektroner i et højere energiniveau (3S) sammenlignet med Berylliums (2S). Dette betyder, at de oplever en lavere effektiv nuklear ladning, hvilket fører til svagere tiltrækning og svagere metallisk binding.
Sammendrag:
Kombinationen af magnesiums mindre atomradius, svagere metallisk binding og lavere effektiv nuklearladning resulterer i svagere interatomiske kræfter, hvilket fører til lavere smeltnings- og kogepunkter sammenlignet med calcium, strontium og de andre elementer under det i gruppe 2.
 Varme artikler
Varme artikler
-
 Nulemissionsdieselforbrænding ved hjælp af et ikke-ligevægtsplasma-assisteret MnO2-filterAktiverede kemiske arter (O 3 , OH-radikaler osv.) dannes ved at inducere et atmosfærisk tryk ikke-ligevægtsplasma. Disse arter fremmer afsvovlings- og denitreringsreaktioner med MnO 2 . I denne a
Nulemissionsdieselforbrænding ved hjælp af et ikke-ligevægtsplasma-assisteret MnO2-filterAktiverede kemiske arter (O 3 , OH-radikaler osv.) dannes ved at inducere et atmosfærisk tryk ikke-ligevægtsplasma. Disse arter fremmer afsvovlings- og denitreringsreaktioner med MnO 2 . I denne a -
 Analyse af biologiske og kemiske skader på byggematerialer fra det 20. århundredeDr. Iratxe Ibarrondo bruger bærbare højopløsningsspektroskopiske teknikker til at analysere påvirkningen på det 20. århundredes byggematerialer af miljøet og de biologiske forhold i det omkringliggend
Analyse af biologiske og kemiske skader på byggematerialer fra det 20. århundredeDr. Iratxe Ibarrondo bruger bærbare højopløsningsspektroskopiske teknikker til at analysere påvirkningen på det 20. århundredes byggematerialer af miljøet og de biologiske forhold i det omkringliggend -
 Artificial Chemist 2.0:Quantum dot R&D på mindre end en timeDette farvehjul af kvanteprikker fremhæver nogle af de farver, der kan laves med Artificial Chemist 2.0. Kredit:Milad Abolhasani, NC State University En ny teknologi, kaldet Artificial Chemist 2.0
Artificial Chemist 2.0:Quantum dot R&D på mindre end en timeDette farvehjul af kvanteprikker fremhæver nogle af de farver, der kan laves med Artificial Chemist 2.0. Kredit:Milad Abolhasani, NC State University En ny teknologi, kaldet Artificial Chemist 2.0 -
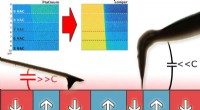 Forbedring af den piezoelektriske mikroskopi karakterisering af keramiske materialerFigur 1:Sidebillede af de to typer anvendte AFM-prober. Den til højre er en ultralang spids, som mindsker den elektrostatiske interaktion mellem udkrageren og prøven. Sammenlignet med standardspidsen,
Forbedring af den piezoelektriske mikroskopi karakterisering af keramiske materialerFigur 1:Sidebillede af de to typer anvendte AFM-prober. Den til højre er en ultralang spids, som mindsker den elektrostatiske interaktion mellem udkrageren og prøven. Sammenlignet med standardspidsen,
- Hvad er en form for energi, der resulterer i, at tiltrækningsobjekter bliver lavet til jern?
- Hvad er kontrolcentret?
- Har proteiner lipider kulhydrater og nukleinsyrer monomerer?
- AI til kode tilskynder til samarbejde, åben videnskabelig opdagelse
- Hvad er vægten af et objekt på månen sammenlignet med jorden?
- Hvorfor reflekterer overflader lys?


