Er det typisk for overgangsmetaller at have isotoper?
* atomstruktur: Overgangsmetaller er placeret midt i det periodiske tabel. De har en kompleks elektronkonfiguration med delvist fyldte D-orbitaler. Dette betyder, at de har et relativt stort antal protoner i deres kerne.
* neutronvariabilitet: Antallet af neutroner i en atoms kerne kan variere, selv for det samme element. Disse variationer kaldes isotoper. Overgangsmetaller med deres høje antal protoner har ofte flere måder at afbalancere de nukleare kræfter med forskellige antal neutroner.
Eksempler:
* jern (Fe): Jern har fire stabile isotoper:Iron-54, Iron-56, Iron-57 og Iron-58.
* kobber (CU): Kobber har to stabile isotoper:kobber-63 og kobber-65.
* cobalt (CO): Cobalt har en stabil isotop, Cobalt-59 og flere radioaktive isotoper.
Kortfattet: Overgangsmetaller er generelt tilbøjelige til at have flere isotoper på grund af deres komplekse atomstruktur og evnen til at variere antallet af neutroner i deres kerne.
 Varme artikler
Varme artikler
-
 Video:Hvordan mælk bliver til ostKredit:The American Chemical Society At lave ost er en gammel øvelse for at bevare mælkens næringsværdi. Og det er også ret lækkert. Med hjælp fra St. James Cheese Company i New Orleans, Reaktion
Video:Hvordan mælk bliver til ostKredit:The American Chemical Society At lave ost er en gammel øvelse for at bevare mælkens næringsværdi. Og det er også ret lækkert. Med hjælp fra St. James Cheese Company i New Orleans, Reaktion -
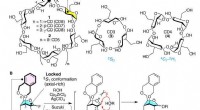 Forskere finder en måde at syntetisere små cyclodextriner påStrukturer af CDer og nøgleelementer muliggjorde syntese af 3 og 4. (A) På grund af de anstrengte glucopyranose-ringe i 3 og 4, deres eksistens blev anset for usandsynlig. (B) Konception af EDB-broen
Forskere finder en måde at syntetisere små cyclodextriner påStrukturer af CDer og nøgleelementer muliggjorde syntese af 3 og 4. (A) På grund af de anstrengte glucopyranose-ringe i 3 og 4, deres eksistens blev anset for usandsynlig. (B) Konception af EDB-broen -
 Optiske overtoner til solcellerAnalogt med et fænomen kendt for musikinstrumenter, når overtoner af to forskellige grundtoner kommer i resonans, forskere fra LMU München har fundet en ny effekt med hensyn til optisk excitation af l
Optiske overtoner til solcellerAnalogt med et fænomen kendt for musikinstrumenter, når overtoner af to forskellige grundtoner kommer i resonans, forskere fra LMU München har fundet en ny effekt med hensyn til optisk excitation af l -
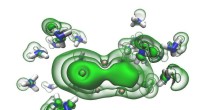 Et forsøg foreslået af en ph.d. elev kan omskrive kemi lærebøgerSolvatiserede elektroner (grønne) i hullerne mellem ammoniakmolekyler (blå og hvide) begynder at smelte sammen til et par, efterhånden som en opløsning bevæger sig mod at blive metallisk. Kredit:Ryan
Et forsøg foreslået af en ph.d. elev kan omskrive kemi lærebøgerSolvatiserede elektroner (grønne) i hullerne mellem ammoniakmolekyler (blå og hvide) begynder at smelte sammen til et par, efterhånden som en opløsning bevæger sig mod at blive metallisk. Kredit:Ryan
- Med en TENG, solceller kan fungere i regn eller solskin
- Sjældent Isaac Newton-manuskript opdaget i korsikansk bibliotek
- Der er en anden kæmpe plastaffaldsplaster i Stillehavet
- Hvad ville der ske, hvis jorden ikke har vippet towet eller væk fra solen?
- Hvordan man forbedrer kritiske orkan-relaterede forsyningskæder
- Hvordan klimakapricer kan udløse planter


