Hvad er oxidationstilstanden for ilt i O2PTF6?
Forståelse af oxidationstilstande
* Oxidationstilstand Repræsenterer den hypotetiske ladning, som et atom ville have, hvis alle dens bindinger var ioniske.
* regler:
* Oxidationstilstanden for elementære atomer er altid 0.
* Fluor har altid en oxidationstilstand på -1.
* Summen af oxidationstilstande i en neutral forbindelse er 0.
Anvendelse af reglerne
1. fluor (f): Da der er seks fluoratomer (F₆), er den samlede oxidationstilstand fra fluor -6.
2. platin (PT): Oxidationstilstanden for platin er +6. Dette skyldes, at det er nødt til at afbalancere -6 -ladningen fra fluoratomerne for at opretholde en neutral forbindelse.
3. ilt (O): Da vi har to iltatomer (O₂), og forbindelsen er neutral, skal den samlede oxidationstilstand fra ilt være +6 (for at annullere -6 fra fluor og +6 fra platin).
* Derfor er oxidationstilstanden for hvert iltatom +3.
Endelig svar: Oxidationstilstanden for ilt i O₂PTF₆ er +3 .
 Varme artikler
Varme artikler
-
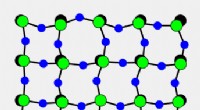 Hemmeligheden bag krystaller, der krymper ved opvarmningDenne animation viser, hvordan faste krystaller af scandiumfluorid krymper ved opvarmning. Mens bindingerne mellem scandium (grøn) og fluoratomer (blå) forbliver relativt stive, fluoratomerne langs si
Hemmeligheden bag krystaller, der krymper ved opvarmningDenne animation viser, hvordan faste krystaller af scandiumfluorid krymper ved opvarmning. Mens bindingerne mellem scandium (grøn) og fluoratomer (blå) forbliver relativt stive, fluoratomerne langs si -
 Et tidligt advarselssystem for skader i kompositmaterialerDet er første gang, at data er blevet brugt på nationalt plan til at vurdere, hvordan miljøets skønhed påvirker udviklingen af vindmølleparker på land. Kredit:CC0 Public Domain Et hold ved Natio
Et tidligt advarselssystem for skader i kompositmaterialerDet er første gang, at data er blevet brugt på nationalt plan til at vurdere, hvordan miljøets skønhed påvirker udviklingen af vindmølleparker på land. Kredit:CC0 Public Domain Et hold ved Natio -
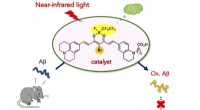 Nær-infrarøde fotoaktiverbare oxygeneringskatalysatorer af amyloidpeptidKredit:Japan Science and Technology Agency (JST) En ny, Der er udviklet biokompatibel fotooxygeneringskatalysator, der selektivt kan ilte og nedbryde den patogene aggregering af Alzheimers sygdom
Nær-infrarøde fotoaktiverbare oxygeneringskatalysatorer af amyloidpeptidKredit:Japan Science and Technology Agency (JST) En ny, Der er udviklet biokompatibel fotooxygeneringskatalysator, der selektivt kan ilte og nedbryde den patogene aggregering af Alzheimers sygdom -
 Renere, stærkere, hårdere:Ny teknologi forbedrer bæredygtig betonKredit:RMIT University Genbrugsbetontilslag lavet med alt fra kaffekopper til byggebrokker giver enorme miljøfordele, fra at reducere losseplads og CO 2 emissioner, at spare på naturressourcerne
Renere, stærkere, hårdere:Ny teknologi forbedrer bæredygtig betonKredit:RMIT University Genbrugsbetontilslag lavet med alt fra kaffekopper til byggebrokker giver enorme miljøfordele, fra at reducere losseplads og CO 2 emissioner, at spare på naturressourcerne
- NIST-søgen efter klimavenlige kølemidler finder komplicerede valg
- En cirkulær strøm af varmere væske og koldere kaldes?
- Anatomi af en acnebehandling
- Hvad søde hunde kan lære os om demokrati
- Såning af hvede tidligere kan hjælpe med at øge udbyttet i Indien
- Hvilken familie af elementer er den mest reaktive ikke -metale familie?


