Hvad er den modsatte reaktion fra en katalysator?
* katalysatorer skaber ikke nye reaktioner: Katalysatorer fremskynder eksisterende reaktioner ved at sænke aktiveringsenergien. De opfinder ikke nye kemiske processer.
* katalysatorer forbruges ikke: Katalysatorer deltager i en reaktion, men regenereres i slutningen. De bliver ikke brugt op.
* katalysatorer kan hæmmes: I stedet for at have en modsat reaktion, kan katalysatorer hæmmes. Dette betyder, at noget griber ind i katalysatorens evne til at arbejde og bremser reaktionen.
For at forstå konceptet bedre, forestil dig en katalysator som matchmaker:
* katalysator: Matchmakeren introducerer mennesker, der ellers ikke ville mødes, hvilket hjælper dem med at danne et forhold (reaktion).
* Ingen modsat reaktion: Der er ingen "anti-matchmaker", der forhindrer folk i at mødes.
* Inhibering: En grumpy nabo kan muligvis prøve at stoppe matchmakerens indsats og bremse processen.
Derfor er det i stedet for "modsat reaktion", det er mere nøjagtigt at tale om:
* Inhibering: Noget, der forhindrer en katalysator i at arbejde.
* deaktivering: Katalysatoren mister sin effektivitet.
* alternative reaktionsveje: Reaktioner kan fortsætte gennem forskellige veje uden en katalysator, men disse veje kan være langsommere eller mindre effektive.
Fortæl mig, hvis du har andre spørgsmål om katalysatorer eller kemiske reaktioner!
Sidste artikelHvad er funktionerne af syre mantel?
Næste artikelHvor mange mol er der i 1.946 af NaCl?
 Varme artikler
Varme artikler
-
 Ny teknik forbereder 2-D perovskit-enkeltkrystaller til højeste fotodetektivitet(001) planet præsenterede den højeste fotodetektivitet. Kredit:DICP En forskningsgruppe ledet af Prof. Liu Shengzhong fra Dalian Institute of Chemical Physics (DICP) fra det kinesiske videnskabsak
Ny teknik forbereder 2-D perovskit-enkeltkrystaller til højeste fotodetektivitet(001) planet præsenterede den højeste fotodetektivitet. Kredit:DICP En forskningsgruppe ledet af Prof. Liu Shengzhong fra Dalian Institute of Chemical Physics (DICP) fra det kinesiske videnskabsak -
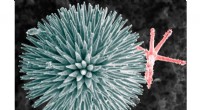 Nærmere kig afslører aksiale filamenter i havsvampspikler, der består af proteinerElektronmikroskopibillede af glasspikler fra svampen Geodia cydonium. Kredit:Zlotnikov Group, B TERNING, TU Dresden Et team af forskere med medlemmer fra Frankrig, Tyskland og Israel har fundet ud
Nærmere kig afslører aksiale filamenter i havsvampspikler, der består af proteinerElektronmikroskopibillede af glasspikler fra svampen Geodia cydonium. Kredit:Zlotnikov Group, B TERNING, TU Dresden Et team af forskere med medlemmer fra Frankrig, Tyskland og Israel har fundet ud -
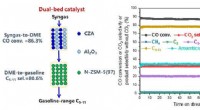 Dobbelts katalysator muliggør høj omdannelse af syngas til flydende carbonhydrider i benzininterva…Skematisk diagram for omdannelsen af syngas til flydende carbonhydrider i benzinområdet over en dobbeltbedskatalysator (CZA+Al2O3)/N-ZSM-5(97) og resultaterne af stabilitetstesten. Kredit:DICP B
Dobbelts katalysator muliggør høj omdannelse af syngas til flydende carbonhydrider i benzininterva…Skematisk diagram for omdannelsen af syngas til flydende carbonhydrider i benzinområdet over en dobbeltbedskatalysator (CZA+Al2O3)/N-ZSM-5(97) og resultaterne af stabilitetstesten. Kredit:DICP B -
 Molekylær indsigt i edderkoppesilkeSkematisk skema af en spidroin bestående af et samlet C-terminalt domæne (cyan), det udfoldede centrale domæne (hvid linje) og de N-terminale domæner (grøn). Højre side:skema af en tilspidsende spinde
Molekylær indsigt i edderkoppesilkeSkematisk skema af en spidroin bestående af et samlet C-terminalt domæne (cyan), det udfoldede centrale domæne (hvid linje) og de N-terminale domæner (grøn). Højre side:skema af en tilspidsende spinde
- At trodse en 150 år gammel regel for faseadfærd
- Associerende og kommutative egenskaber ved multiplikation
- Nyt canadisk radioteleskop registrerer hurtige radioudbrud
- Amerikansk militær hævdede succes med at hacke ISIS:dokumenter
- Hvilken information beskriver bedst et atoms atomnummer?
- At følge atomer i realtid kan føre til bedre materialedesign


