Hvad er bindingsmedarbejderen med et hydrat og kan CUSO4 blive tørremiddel?
binding i hydrater
Hydrater er forbindelser, der indeholder vandmolekyler i deres krystalstruktur. Den limning, der er forbundet med hydrater, er koordinationsbinding .
Sådan fungerer det:
* Vandmolekyler Virk som ligander, som er molekyler eller ioner, der donerer et ensomt par elektroner til en metalion.
* metalioner I hydratet accepterer disse elektronpar ved at danne koordinat kovalente bindinger.
F.eks. I kobber (II) sulfatpentahydrat (cuso₄ · 5H₂O) danner kobber (II) ion (cu²⁺) koordinatbindinger med iltatomer af vandmolekyler. Denne interaktion er repræsenteret af DOT (·) i den kemiske formel, hvilket betyder, at vandmolekylerne er direkte forbundet med kobbersulfatet.
kan cuso₄ blive et tørremiddel?
Ja, vandfri kobber (II) sulfat (cuso₄) kan fungere som et tørremiddel. Dette betyder, at det kan absorbere fugt fra den omgivende luft.
Her er hvorfor:
* Hydrering er eksoterm: Processen med vandfri cuso₄ -absorberende vand til dannelse af cuso₄ · 5H₂o frigiver varme.
* farveændring: Den vandfri cuso₄ er hvid, men det bliver blåt, når det absorberer vand, hvilket gør det let at visuelt identificere dets tørremiddelaktivitet.
Imidlertid er kobber (II) sulfatpentahydrat (cuso₄ · 5H₂o) ikke et tørremiddel Fordi det allerede har vandmolekyler i dens struktur.
Derfor kan kun den vandfri form af cuso₄ fungere som et tørremiddel .
 Varme artikler
Varme artikler
-
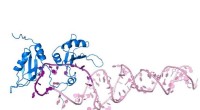 Ny indsigt i modning af miRNA'erForfatterne var i stand til at vise nøjagtigt, hvordan et specifikt RNA-bindende protein (blåt) genkender pri-miR-18a (pink) og ændrer dets struktur på en sådan måde, at det udvikler sig til modent mi
Ny indsigt i modning af miRNA'erForfatterne var i stand til at vise nøjagtigt, hvordan et specifikt RNA-bindende protein (blåt) genkender pri-miR-18a (pink) og ændrer dets struktur på en sådan måde, at det udvikler sig til modent mi -
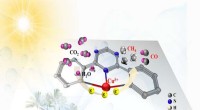 Ny katalysator øger radikalt omdannelseshastigheden af kuldioxid til solbrændstofferForskere konstruerede en enkelt atom katalysator (SAC) med en kovalent triazin-baseret ramme, hvormed fotokatalytisk CO2 blev omdannet til solenergi. Den fremstillede fotokatalysator udviste fremragen
Ny katalysator øger radikalt omdannelseshastigheden af kuldioxid til solbrændstofferForskere konstruerede en enkelt atom katalysator (SAC) med en kovalent triazin-baseret ramme, hvormed fotokatalytisk CO2 blev omdannet til solenergi. Den fremstillede fotokatalysator udviste fremragen -
 Oxidsintring ved lufttrykskontrolOpstilling af en prøve i en lufttryksreguleringsatmosfæreovn. Kredit:Toyohashi University of Technology Professor Hiromi Nakano fra Toyohashi University of Technology har samarbejdet med en virkso
Oxidsintring ved lufttrykskontrolOpstilling af en prøve i en lufttryksreguleringsatmosfæreovn. Kredit:Toyohashi University of Technology Professor Hiromi Nakano fra Toyohashi University of Technology har samarbejdet med en virkso -
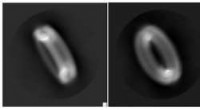 Guardians of the Ring—Forskere afslører strukturen af protein involveret i inflammatoriske sygdom…Cryo-EM-teknologi fangede elegante detaljer i gasdermin-poren. Kredit:Wu lab Når kroppen opdager en trussel, det være sig en viral invader eller en Alzheimers sygdom plaque, guardian proteiner på
Guardians of the Ring—Forskere afslører strukturen af protein involveret i inflammatoriske sygdom…Cryo-EM-teknologi fangede elegante detaljer i gasdermin-poren. Kredit:Wu lab Når kroppen opdager en trussel, det være sig en viral invader eller en Alzheimers sygdom plaque, guardian proteiner på
- Hvordan opstår geotermisk energi?
- WHO har ofte været under beskydning, men ingen nation har nogensinde flyttet for at bryde båndene …
- Instagram slår hårdt ned på tvivlsomme vægttabsannoncer og kosmetisk kirurgi
- Gaveguide 2018:Idéer til snoreklippere og wannabes
- Forskere belyser, hvordan IGF2's sekretoriske vej medierer muskelstamcelledifferentiering
- Hollandsk domstol vil behandle en ny sag om I.Coast -kemikalieudslip


