Hvad indeholder en ikke -polær kovalent binding?
Her er nogle eksempler på molekyler, der indeholder ikke -polære kovalente bindinger:
* H₂ (brintgas): To hydrogenatomer deler deres enkelt elektron hver, hvilket resulterer i en ikke -polær kovalent binding.
* o₂ (iltgas): To iltatomer deler to par elektroner, hvilket resulterer i en ikke -polær kovalent binding.
* n₂ (nitrogengas): To nitrogenatomer deler tre par elektroner, hvilket resulterer i en ikke -polær kovalent binding.
* cl₂ (klorgas): To kloratomer deler et par elektroner, hvilket resulterer i en ikke -polær kovalent binding.
* br₂ (bromvæske): To bromatomer deler et par elektroner, hvilket resulterer i en ikke -polær kovalent binding.
* i₂ (iod fast stof): To jodatomer deler et par elektroner, hvilket resulterer i en ikke -polær kovalent binding.
Bemærk: Mens ovenstående eksempler er alle diatomiske molekyler (molekyler lavet af to atomer), kan større molekyler også indeholde ikke -polære kovalente bindinger, hvis de involverede atomer er det samme element, og elektronerne deles lige.
Sidste artikelKontrast saltvand og frisk vand?
Næste artikelHvad er brugen af arsen 74?
 Varme artikler
Varme artikler
-
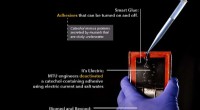 Ingeniører zapper og løsner smart undervandslimTænd og sluk for vedhæftning er det, der gør en lim smart. Det er én ting at gøre dette i det fri og noget helt andet under vand. Inspireret af naturen, katekoler er syntetiske forbindelser, der efter
Ingeniører zapper og løsner smart undervandslimTænd og sluk for vedhæftning er det, der gør en lim smart. Det er én ting at gøre dette i det fri og noget helt andet under vand. Inspireret af naturen, katekoler er syntetiske forbindelser, der efter -
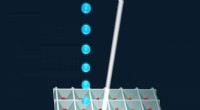 Happy hour for tidsopløst krystallografiLiquid Application Method for time-resolved Analyses (LAMA) åbner døren for alle diffusionsvenlige proteinkrystalsystemer. Kredit:Joerg M. Harms, MPSD Forskere fra Department of Atomically Resolve
Happy hour for tidsopløst krystallografiLiquid Application Method for time-resolved Analyses (LAMA) åbner døren for alle diffusionsvenlige proteinkrystalsystemer. Kredit:Joerg M. Harms, MPSD Forskere fra Department of Atomically Resolve -
 Forbløffende effekt muliggør bedre palladiumkatalysatorerSe ind i ultrahøjvakuumkammeret (katalysatorprøve i midten). Kredit:Vienna University of Technology I kemi, atomer kan normalt kun påvirke deres umiddelbare naboskab. På TU Wien, en ny effekt med
Forbløffende effekt muliggør bedre palladiumkatalysatorerSe ind i ultrahøjvakuumkammeret (katalysatorprøve i midten). Kredit:Vienna University of Technology I kemi, atomer kan normalt kun påvirke deres umiddelbare naboskab. På TU Wien, en ny effekt med -
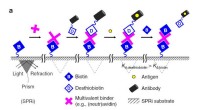 Bare at klikke et molekyle til et biomolekyle for en anden funktionEt desthiobiotin molekyle, inklusive antistof og et antigen, gør plads til biotin. Kredit:University of Twente Forskere har rapporteret et materiale, der styrer cellers adfærd på en dynamisk måde,
Bare at klikke et molekyle til et biomolekyle for en anden funktionEt desthiobiotin molekyle, inklusive antistof og et antigen, gør plads til biotin. Kredit:University of Twente Forskere har rapporteret et materiale, der styrer cellers adfærd på en dynamisk måde,
- Tærte fra himlen:dronelevering lander i Amerika
- Hvorfor vi bygger netværk, der skader vores præstation, og hvad kan vi gøre ved det
- Hvad er den tyndeste del af Jordens interiør?
- At spise knoglemarv spillede en nøglerolle i udviklingen af den menneskelige hånd
- Hvilken type forbindelse og binding hydrolyseres af alfa-amylasen?
- Sådan diagrammer du fraktioner


