Hvordan fører eksistensen af polaritet inden for et molekyle op til dens evne opløses?
Polaritet og intermolekylære kræfter:
* polære molekyler Har en ujævn fordeling af elektrondensitet, hvilket resulterer i en delvis positiv ladning i den ene ende og en delvis negativ ladning på den anden. Dette skaber et dipolmoment.
* ikke -polære molekyler Har en ensartet fordeling af elektrondensitet uden forskellige afgifter.
* polære molekyler Interagere med andre polære molekyler gennem dipol-dipol-interaktioner , som er relativt stærke intermolekylære kræfter.
* ikke -polære molekyler interagere med hinanden gennem London -spredningskræfter , som er svagere intermolekylære kræfter.
"Like opløser som" regel:
* polære opløsningsmidler (som vand) er gode til at opløse polære opløsninger (som sukker). Dette skyldes, at dipol-dipolinteraktionerne mellem opløsningsmidlet og opløst molekyler er stærke nok til at overvinde de intermolekylære kræfter, der holder opløsningen.
* ikke -polære opløsningsmidler (som olie) er gode til at opløse ikke -polære opløste stoffer (som fedt). Dette skyldes, at London -spredningskræfterne mellem opløsningsmidlet og opløste molekyler er tilstrækkelige til at overvinde de intermolekylære kræfter, der holder opløsningen.
Eksempler:
* vand (polær) Opløser salt (ionisk og polær) Fordi vandmolekylerne kan omringe ionerne og adskille dem.
* olie (ikke -polær) Opløs fedt (ikke -polær) Fordi de svage intermolekylære kræfter mellem olie- og fedtmolekylerne er tilstrækkelige til at tillade blanding.
Undtagelser:
* Nogle molekyler har både polære og ikke -polære dele, hvilket gør dem amfipatiske . Disse molekyler kan undertiden opløses i både polære og ikke -polære opløsningsmidler. F.eks. Har SOAP -molekyler et polært hoved og en ikke -polær hale, der giver dem mulighed for at opløses i både vand og olie.
Kortfattet: Polariteten af et molekyle dikterer dens evne til at opløses i et opløsningsmiddel baseret på styrken af intermolekylære kræfter mellem opløsningsmidlet og opløst molekyler. Reglen "som opløser som" er en nyttig retningslinje for at forudsige opløselighed.
 Varme artikler
Varme artikler
-
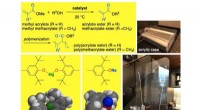 Industriel forbindelse får en miljøvenlig reaktionNatrium- eller magnesiumaryloxider kan katalysere transesterificeringen af methyl(meth)acrylat ved stuetemperatur, med høj kemoselektivitet, producerer et højt udbytte af (meth) acrylatester, og ude
Industriel forbindelse får en miljøvenlig reaktionNatrium- eller magnesiumaryloxider kan katalysere transesterificeringen af methyl(meth)acrylat ved stuetemperatur, med høj kemoselektivitet, producerer et højt udbytte af (meth) acrylatester, og ude -
 Designet protein switch tillader hidtil uset kontrol over levende cellerLOCKR er en molekylær kontakt lavet af flere interagerende dele:en nøgle (sort) låser op for et bur (grå), afsløre et bioaktivt peptid (gult), som kan interagere med andre molekyler i cellen. LÅS, e
Designet protein switch tillader hidtil uset kontrol over levende cellerLOCKR er en molekylær kontakt lavet af flere interagerende dele:en nøgle (sort) låser op for et bur (grå), afsløre et bioaktivt peptid (gult), som kan interagere med andre molekyler i cellen. LÅS, e -
 Beregningsmæssig forskning beskriver aktiveringsmekanismen for p38-alfaForskere afslørede detaljer om p38 -aktiveringsmekanismen. Billedet repræsenterer de strukturelle ændringer fra den inaktive tilstand (lilla) til den aktive (grøn) foreslået af røntgenkrystallografi.
Beregningsmæssig forskning beskriver aktiveringsmekanismen for p38-alfaForskere afslørede detaljer om p38 -aktiveringsmekanismen. Billedet repræsenterer de strukturelle ændringer fra den inaktive tilstand (lilla) til den aktive (grøn) foreslået af røntgenkrystallografi. -
 Klimatilbagespoling:Forskere omdanner kuldioxid tilbage til kulEn skematisk illustration, der viser, hvordan flydende metal bruges som katalysator til at omdanne kuldioxid til fast kul. Kredit:RMIT University Forskere har brugt flydende metaller til at omdann
Klimatilbagespoling:Forskere omdanner kuldioxid tilbage til kulEn skematisk illustration, der viser, hvordan flydende metal bruges som katalysator til at omdanne kuldioxid til fast kul. Kredit:RMIT University Forskere har brugt flydende metaller til at omdann
- At give indianerne på landet, hvad de ønsker, øger efterspørgslen efter kogeovne
- Forskning afslører, hvorfor bekæmpelse af partikelforurening fører til en stigning i fotokemisk s…
- Hvilket atom har lignende egenskaber som oxygen?
- Revolution i flugt
- Hvad ville reducere reaktanthastigheden?
- Nyt værktøj til at fremskynde opdagelse af lægemidler


