Hvad er normaliteten af en 0,10 m opløsningsfosforsyre?
Forståelse af normalitet
* Normalitet (n) Repræsenterer antallet af ækvivalenter af et opløst stof pr. Liter opløsning.
* ækvivalenter er antallet af mol reaktive enheder (som H+ -ioner) i en opløsning.
phosphorsyre (H₃po₄)
* Fosforsyre har tre sure protoner (H+ -ioner), der kan frigøres.
Beregning
1. Identificer antallet af ækvivalenter: Da fosforsyre har 3 sure protoner, tilvejebringer hver mol H₃po₄ 3 ækvivalenter af H+ -ioner.
2. Beregn normalitet:
* Normalitet (n) =molaritet (m) x antal ækvivalenter pr. Mol
* N =0,10 m x 3
* n =0,30 n
Derfor har en 0,10 m opløsning af fosforsyre en normalitet på 0,30 n.
Sidste artikelHvad er laboratoriets normalitet af HNO3?
Næste artikelTre-carbonmolekyler af PGA konverteres til energirige G3P-sukker ved.?
 Varme artikler
Varme artikler
-
 En type halvgennemsigtig polymer, der kan repareres ved stuetemperatur ved hjælp af lille trykKredit:Yu Yanagisawa Et lille team af forskere ved University of Tokyo har skabt en polymer, der kan repareres, når den brydes i to dele ved at påføre et lille tryk ved stuetemperatur. I deres pap
En type halvgennemsigtig polymer, der kan repareres ved stuetemperatur ved hjælp af lille trykKredit:Yu Yanagisawa Et lille team af forskere ved University of Tokyo har skabt en polymer, der kan repareres, når den brydes i to dele ved at påføre et lille tryk ved stuetemperatur. I deres pap -
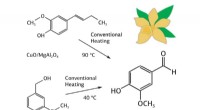 Kemiker skaber billige katalysatorer til produktion af vanillinKredit:RUDN University En kemiker fra RUDN University har skabt billige og effektive katalysatorer til produktion af vanillin ved hjælp af spinel -nanopartikler med kobberoxid -nanopartikler. Hydr
Kemiker skaber billige katalysatorer til produktion af vanillinKredit:RUDN University En kemiker fra RUDN University har skabt billige og effektive katalysatorer til produktion af vanillin ved hjælp af spinel -nanopartikler med kobberoxid -nanopartikler. Hydr -
 Proteinmiljøet gør katalysatoren effektiv til brintproduktionBochum -forskerne Martin Winkler, Oliver Lampret og Thomas Happe (fra venstre mod højre) sammen med Olaf Rüdiger (i baggrunden) fra Max Planck Institute. Kredit:RUB, Marquard Interaktionen mellem
Proteinmiljøet gør katalysatoren effektiv til brintproduktionBochum -forskerne Martin Winkler, Oliver Lampret og Thomas Happe (fra venstre mod højre) sammen med Olaf Rüdiger (i baggrunden) fra Max Planck Institute. Kredit:RUB, Marquard Interaktionen mellem -
 Design af en mere sikker byggesten til opdagelse af stoffer ved at udnytte synligt lysStephenson -laboratoriet bruger blå lysdioder til at aktivere deres fotokatalysatorer. Kredit:Stephenson Lab Når du når en flaske acetaminophen, du leder muligvis efter lindring af hovedpine. Men
Design af en mere sikker byggesten til opdagelse af stoffer ved at udnytte synligt lysStephenson -laboratoriet bruger blå lysdioder til at aktivere deres fotokatalysatorer. Kredit:Stephenson Lab Når du når en flaske acetaminophen, du leder muligvis efter lindring af hovedpine. Men
- Hvad af følgende er en karakteristisk metallisk?
- En lille plesiosaur levede i Spanien for 125 millioner år siden
- Mine håndværk til Mars
- Sådan finder du P-værdier ved hjælp af Texas Instruments TI-83 Calculator
- Kan du bruge et 12V 12Ah -batteri i stedet for 8AH -batteri?
- Hvordan vil elektronpar opføre sig mod hinanden i VSEPR?


