Hvad sker der, når Al reagerer med FESO4?
reaktion:
2 Al (s) + 3 Feso₄ (aq) → Al₂ (SO₄) ₃ (aq) + 3 Fe (s)
Forklaring:
* aluminium (AL) er mere reaktiv end jern (Fe) . Dette betyder, at aluminium har en stærkere tendens til at miste elektroner og danne positive ioner.
* Når aluminium anbringes i en opløsning af jern (II) sulfat, fortrænger det jernioner fra opløsningen.
* aluminium (AL) Mister elektroner og danner aluminiumioner (al³⁺).
* jern (Fe) Ioner får elektroner og danner jernatomer (Fe).
* Sulfationerne (SO₄²⁻) forbliver i opløsning.
* aluminiumssulfat (al₂ (so₄) ₃) er dannet, som er opløselig i vand.
* jern (Fe) deponeres som et solidt.
Observationer:
* Du vil observere dannelsen af et gråt sort fast (jern) i bunden af beholderen.
* Løsningen ville ændre farve fra lysegrøn (feso₄) til farveløs (al₂ (so₄) ₃).
Bemærk: Denne reaktion er et klassisk eksempel på en enkelt forskydningsreaktion, og den demonstrerer reaktivitetsserien af metaller. Det mere reaktive metal vil altid fortrænge det mindre reaktive metal fra dets saltopløsning.
 Varme artikler
Varme artikler
-
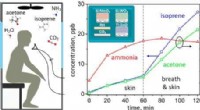 Bærbar enhed til at snuse ud fangede menneskerKredit:American Chemical Society Det første trin efter bygninger kollapsede fra et jordskælv, bombning eller anden katastrofe er at redde mennesker, der kunne blive fanget i murbrokkerne. Men at f
Bærbar enhed til at snuse ud fangede menneskerKredit:American Chemical Society Det første trin efter bygninger kollapsede fra et jordskælv, bombning eller anden katastrofe er at redde mennesker, der kunne blive fanget i murbrokkerne. Men at f -
 Overflader, der griber som gekkofødder, kunne nemt masseproduceresFleksible vægge, her i blå, et par hundrede mikrometer høj efterligner overfladen af en gekkos fod for at skabe den samme form for klæbekraft - men meget, meget stærkere end dyrets pote. Kredit:Geor
Overflader, der griber som gekkofødder, kunne nemt masseproduceresFleksible vægge, her i blå, et par hundrede mikrometer høj efterligner overfladen af en gekkos fod for at skabe den samme form for klæbekraft - men meget, meget stærkere end dyrets pote. Kredit:Geor -
 Forskere opløser råolie i vand for at studere dens sammensætningIllustration. Olie opløst i vand. Kredit:@tsarcyanide/MIPT Forskere fra MIPT, Skoltech, Det Russiske Videnskabsakademis Fælles Institut for Høje Temperaturer, og Lomonosov Moscow State University
Forskere opløser råolie i vand for at studere dens sammensætningIllustration. Olie opløst i vand. Kredit:@tsarcyanide/MIPT Forskere fra MIPT, Skoltech, Det Russiske Videnskabsakademis Fælles Institut for Høje Temperaturer, og Lomonosov Moscow State University -
 Selvreplikator, der samtidig skabes og ødelægges, kan føre til en bedre forståelse af livet(Venstre) Koncentration af forskellige forbindelser:råmaterialer (blå), produkt (rød), affaldsprodukt (sort). (Til højre) Selvreplikationsproces. Kredit:Colomer et al. Udgivet i Naturkommunikation .
Selvreplikator, der samtidig skabes og ødelægges, kan føre til en bedre forståelse af livet(Venstre) Koncentration af forskellige forbindelser:råmaterialer (blå), produkt (rød), affaldsprodukt (sort). (Til højre) Selvreplikationsproces. Kredit:Colomer et al. Udgivet i Naturkommunikation .
- Dyrefri metode forudsiger nanopartikeltoksicitet for sikrere industrielle materialer
- Undersøgelsen finder store forskelle i deltagelse i aktiviteter uden for undervisningen afhængigt …
- Undersøgelse rekonstruerer gamle storme for at hjælpe med at forudsige ændringer i tropisk cyklon…
- CO2-fodaftryk og prissætning under klimahensyn
- Effektive metoder til at simulere, hvordan elektromagnetiske bølger interagerer med enheder
- Populistiske euroskeptikere vinder ikke ved terrorangreb


