Hvad er forbindelsen mellem temperaturkollisioner og reaktionshastighed?
* Forøget temperatur fører til hyppigere og energiske kollisioner.
* hyppigere og energiske kollisioner øger sandsynligheden for vellykkede kollisioner, der fører til en kemisk reaktion.
* Derfor fører en højere temperatur til en hurtigere reaktionshastighed.
Her er en mere detaljeret sammenbrud:
Temperatur og kollisioner:
* kinetisk energi: Temperaturen er et mål for den gennemsnitlige kinetiske energi af molekyler. Højere temperatur betyder, at molekyler bevæger sig hurtigere og har mere kinetisk energi.
* Kollisionsfrekvens: Når molekyler bevæger sig hurtigere, kolliderer de oftere med hinanden.
* Kollisionsenergi: Højere kinetisk energi betyder også, at molekyler kolliderer med større kraft.
Kollisioner og reaktionshastighed:
* Aktiveringsenergi: Hver kemisk reaktion har en aktiveringsenergibarriere, der skal overvindes for reaktanter for at danne produkter.
* Succesrige kollisioner: Kun kollisioner med tilstrækkelig energi til at overvinde aktiveringsenergien kan resultere i en kemisk reaktion.
* reaktionshastighed: Hastigheden for en reaktion bestemmes af hyppigheden af vellykkede kollisioner.
Kortfattet:
* Højere temperatur: Flere energiske molekyler, hyppigere og energiske kollisioner.
* flere energiske kollisioner: Øget sandsynlighed for at overvinde aktiveringsenergi.
* øget sandsynlighed for at overvinde aktiveringsenergi: Mere vellykkede kollisioner, hvilket fører til en hurtigere reaktionshastighed.
Eksempel:
Forestil dig et overfyldt rum, hvor folk prøver at have samtaler.
* Lav temperatur: Folk bevæger sig langsomt og har få samtaler.
* Høj temperatur: Folk bevæger sig hurtigt og har mange samtaler.
Det samme princip gælder for molekyler. Jo højere temperatur er, desto hyppigere og energiske kollisioner, hvilket fører til en højere hastighed af "samtaler" (kemiske reaktioner).
 Varme artikler
Varme artikler
-
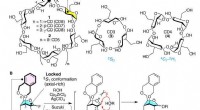 Forskere finder en måde at syntetisere små cyclodextriner påStrukturer af CDer og nøgleelementer muliggjorde syntese af 3 og 4. (A) På grund af de anstrengte glucopyranose-ringe i 3 og 4, deres eksistens blev anset for usandsynlig. (B) Konception af EDB-broen
Forskere finder en måde at syntetisere små cyclodextriner påStrukturer af CDer og nøgleelementer muliggjorde syntese af 3 og 4. (A) På grund af de anstrengte glucopyranose-ringe i 3 og 4, deres eksistens blev anset for usandsynlig. (B) Konception af EDB-broen -
 Ny forbindelse kan forbedre fotodynamisk terapi mod kræftKredit:CC0 Public Domain Forskere ved University of Sheffield har syntetiseret en ny forbindelse, der kan forbedre succesraten for fotodynamisk terapi ved behandling af kræft. Nøglen til fotodyna
Ny forbindelse kan forbedre fotodynamisk terapi mod kræftKredit:CC0 Public Domain Forskere ved University of Sheffield har syntetiseret en ny forbindelse, der kan forbedre succesraten for fotodynamisk terapi ved behandling af kræft. Nøglen til fotodyna -
 Solmateriale kan selvhelbredende ufuldkommenheder, viser ny forskningKredit:CC0 Public Domain Et materiale, der kan bruges i teknologier som solenergi, har vist sig at selvhelbredende, viser en ny undersøgelse. Resultaterne - fra University of York - rejser udsigt
Solmateriale kan selvhelbredende ufuldkommenheder, viser ny forskningKredit:CC0 Public Domain Et materiale, der kan bruges i teknologier som solenergi, har vist sig at selvhelbredende, viser en ny undersøgelse. Resultaterne - fra University of York - rejser udsigt -
 Ny metode muliggør effektiv prøveforberedelse til enkeltcellet proteomikKredit:Kumamoto University Proteinerne, der udgør vores celler, rummer en hel verden af information, som, når de er låst op, kan give os indsigt i oprindelsen af mange væsentlige biologiske fæn
Ny metode muliggør effektiv prøveforberedelse til enkeltcellet proteomikKredit:Kumamoto University Proteinerne, der udgør vores celler, rummer en hel verden af information, som, når de er låst op, kan give os indsigt i oprindelsen af mange væsentlige biologiske fæn


