Hvilke periodiske tendenser med reaktivitet forekommer med alkalimetaller?
1. Stigende reaktivitet ned i gruppen:
* Faldende ioniseringsenergi: Når du bevæger dig ned i gruppen, er den yderste elektron længere væk fra kernen og oplever svagere tiltrækning. Dette gør det lettere at fjerne elektronet, hvilket resulterer i lavere ioniseringsenergi.
* Større atomradius: Med stigende atomradius er den yderste elektron længere væk fra kernen, hvilket fører til en svagere attraktion. Dette gør elektronet lettere at miste og bidrager til højere reaktivitet.
* lavere effektiv nuklearafgift: Afskærmningseffekten af indre elektroner øges, når du går ned i gruppen. Dette reducerer den effektive atomafgift, der opleves af den yderste elektron, hvilket gør det lettere at fjerne og forbedre reaktiviteten.
2. Stærke reduktionsmidler:
* let at miste elektroner: På grund af de ovennævnte faktorer mister alkalimetaller let deres enkelt valenselektron, hvilket gør dem til stærke reduktionsmidler. De donerer let elektroner til andre elementer, hvilket får de andre elementer til at blive reduceret.
3. Reaktion med vand:
* voldelige reaktioner: Alkalimetaller reagerer kraftigt med vand og producerer brintgas og metalhydroxider. Reaktionen bliver stadig mere voldelig, når du bevæger dig ned ad gruppen, hvor lithium reagerer langsomt, natrium reagerer kraftigt og kalium reagerer eksplosivt.
4. Reaktion med halogener:
* ioniske forbindelser: Alkalimetaller reagerer let med halogener for at danne ioniske forbindelser, såsom natriumchlorid (NaCI). Reaktiviteten øges, når du går ned i gruppen.
5. Dannelse af oxider:
* Oxidation: Når de udsættes for luft, reagerer alkalimetaller med ilt for at danne oxider. Reaktiviteten over for ilt øges ned i gruppen.
Sammenfattende øges reaktiviteten af alkalimetaller ned i gruppen på grund af faldende ioniseringsenergi, større atomradius, lavere effektiv nuklear ladning og deres tendens til let at miste elektroner, hvilket gør dem til stærke reduktionsmidler.
 Varme artikler
Varme artikler
-
 Omdannelse af kuldioxid til kulilte ved hjælp af vand, elektricitetReduktion af CO 2 . Kredit:Mr. Aditya Prajapati Forskere ved University of Illinois i Chicago og Joint Center for Artificial Photosynthesis har fastslået, hvordan elektrokatalysatorer kan omdann
Omdannelse af kuldioxid til kulilte ved hjælp af vand, elektricitetReduktion af CO 2 . Kredit:Mr. Aditya Prajapati Forskere ved University of Illinois i Chicago og Joint Center for Artificial Photosynthesis har fastslået, hvordan elektrokatalysatorer kan omdann -
 Mekanokemisk peptidbindingsdannelse bag livets oprindelseKredit:CC0 Public Domain Tilstedeværelsen af aminosyrer på den præbiotiske jord er bredt accepteret, enten kommer fra endogene kemiske processer eller leveres af udenjordisk materiale. På den an
Mekanokemisk peptidbindingsdannelse bag livets oprindelseKredit:CC0 Public Domain Tilstedeværelsen af aminosyrer på den præbiotiske jord er bredt accepteret, enten kommer fra endogene kemiske processer eller leveres af udenjordisk materiale. På den an -
 Produktion af drop-in brændstof fra biomasse ved mikrobiel og elektrokemisk omdannelseForskere har vist, at kombinationen af mikrobiel og elektrokemisk omdannelse af biomasse kan give værdifulde produkter. Kredit:UFZ / André Künzelmannn Forskere ved Helmholtz Center for Miljøfors
Produktion af drop-in brændstof fra biomasse ved mikrobiel og elektrokemisk omdannelseForskere har vist, at kombinationen af mikrobiel og elektrokemisk omdannelse af biomasse kan give værdifulde produkter. Kredit:UFZ / André Künzelmannn Forskere ved Helmholtz Center for Miljøfors -
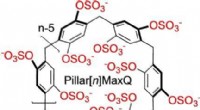 Molekylære beholdere til sekvestrering af neurotransmitterlægemidler i vandPillar[n]MaxQ:En ny værtsfamilie med høj affinitet til sekvestration i vand. Kredit:Angewandte Chemie International Edition Molekylære beholdere, der fjerner stoffer, toksiner, eller ildelugtende
Molekylære beholdere til sekvestrering af neurotransmitterlægemidler i vandPillar[n]MaxQ:En ny værtsfamilie med høj affinitet til sekvestration i vand. Kredit:Angewandte Chemie International Edition Molekylære beholdere, der fjerner stoffer, toksiner, eller ildelugtende
- Racemæssig skævhed betyder noget på crowdfunding-sider som Indiegogo, Kickstarter, og GoFundMe
- Mandlige lærere vurderer højst sandsynligt højt i feedback fra universitetsstuderende
- Forskere kombinerer lasere og terahertz-bølger i kameraet, der ser usete detaljer
- Projekter inden for videnskabsmesse til 9. klasse
- Forskning baner vej for forbedrede lasere, kommunikation
- Ren metalasteroide har mystiske vandaflejringer


