Hvilken type forbindelse er en svag binding mellem molekyler?
Her er en sammenbrud:
* Intermolekylære kræfter er attraktive kræfter mellem molekyler. De er meget svagere end intramolekylære kræfter der holder atomer sammen i et molekyle.
* intramolekylære kræfter er de stærke kemiske bindinger (som kovalente eller ioniske bindinger), der holder atomer sammen i et molekyle.
Der er tre hovedtyper af intermolekylære kræfter:
1. Hydrogenbinding: En speciel type dipol-dipolinteraktion, der opstår, når brint er bundet til et stærkt elektronegativt atom som ilt, nitrogen eller fluor. Det er den stærkeste type intermolekylær kraft.
2. dipol-dipol-interaktioner: Forekommer mellem polære molekyler, der har et permanent dipolmoment på grund af ujævn deling af elektroner.
3. London Dispersion Forces: Forekommer mellem alle molekyler, endda ikke -polære. De stammer fra midlertidige udsving i elektronfordeling og skaber midlertidige dipoler. Dette er den svageste type intermolekylær kraft.
Styrken af disse intermolekylære kræfter spiller en betydelig rolle i bestemmelsen af et stofs fysiske egenskaber som smeltepunkt, kogepunkt og viskositet.
 Varme artikler
Varme artikler
-
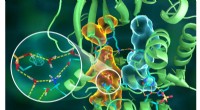 Neutroner maler atomportræt af prototypisk cellesignalingsenzymIllustration af den indviklede organisering af PKA -strukturen, hvor forskellige dele af proteinet er forbundet via udførlige hydrogenbindingsnetværk (stiplede gule linjer), limet sammen af de hydro
Neutroner maler atomportræt af prototypisk cellesignalingsenzymIllustration af den indviklede organisering af PKA -strukturen, hvor forskellige dele af proteinet er forbundet via udførlige hydrogenbindingsnetværk (stiplede gule linjer), limet sammen af de hydro -
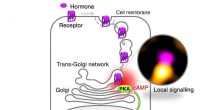 Hvordan receptorer for medicin virker inde i cellerNyopdaget mekanisme for GPCR-signalering ved trans-Golgi-netværket (TGN). Ved binding af et hormon (TSH), receptoren optages af cellen (internalisering) og transporteres til TGN, hvor det inducerer lo
Hvordan receptorer for medicin virker inde i cellerNyopdaget mekanisme for GPCR-signalering ved trans-Golgi-netværket (TGN). Ved binding af et hormon (TSH), receptoren optages af cellen (internalisering) og transporteres til TGN, hvor det inducerer lo -
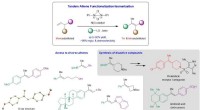 Stereoselektiv alkensyntese med ikke-ædel nikkelkatalyseSkematisk, der viser udviklingen af et nyt Ni-katalyseret system, der konverterer billige og let tilgængelige monosubstituerede olefiner til højværdi tri- og tetrasubstituerede analoger, og dets anv
Stereoselektiv alkensyntese med ikke-ædel nikkelkatalyseSkematisk, der viser udviklingen af et nyt Ni-katalyseret system, der konverterer billige og let tilgængelige monosubstituerede olefiner til højværdi tri- og tetrasubstituerede analoger, og dets anv -
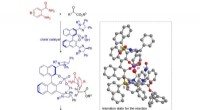 Ny metode til asymmetrisk N, N-acetalsyntese lover fremskridt inden for lægemiddeludviklingKredit:Nagoya Institute of Technology Mange af vores lægemidler og andre bioaktive lægemidler er baseret på kemiske strukturer kaldet enantiomerer - molekyler, der er spejlbilleder af hinanden og
Ny metode til asymmetrisk N, N-acetalsyntese lover fremskridt inden for lægemiddeludviklingKredit:Nagoya Institute of Technology Mange af vores lægemidler og andre bioaktive lægemidler er baseret på kemiske strukturer kaldet enantiomerer - molekyler, der er spejlbilleder af hinanden og
- Hvordan adskiller kaukaer sig fra primær?
- FORKLARER:Hvad er cikader, og hvorfor plager de nogle mennesker?
- Optimering af laserdrevet elektronacceleration
- Udsatte boligejere kan give afkald på oversvømmelsesforsikring
- Hvordan reduceret tyngdekraft påvirker astronauters muskler og nerverespons
- Arctic Edmontosaurus lever igen:Et nyt blik på rensdyret i Kridttiden


