Hvad er en katalysator?
Her er en sammenbrud:
* Kemiske reaktioner: Disse involverer brud og dannelse af kemiske bindinger. Nogle reaktioner sker hurtigt, mens andre tager meget lang tid.
* Aktiveringsenergi: Dette er den mindste mængde energi, som reaktanter skal have for at starte en reaktion.
* katalysatorens rolle: En katalysator sænker aktiveringsenergien ved at tilvejebringe en alternativ rute til reaktionen til at fortsætte. Dette betyder, at reaktionen kan ske hurtigere ved en given temperatur.
nøglefunktioner ved katalysatorer:
* ikke konsumeret: En katalysator bruges ikke op i reaktionen; Det kan gendannes og genanvendes.
* specifikt: Katalysatorer er ofte specifikke for en bestemt reaktion eller en type reaktion.
* kan være homogen eller heterogen:
* homogene katalysatorer: Eksisterer i den samme fase (fast, flydende eller gas) som reaktanter.
* heterogene katalysatorer: Eksisterer i en anden fase end reaktanterne (f.eks. En fast katalysator i en flydende reaktion).
Eksempler på katalysatorer:
* enzymer: Biologiske katalysatorer, der letter biokemiske reaktioner inden for levende organismer.
* platin: Brugt i katalytiske omformere i biler til at omdanne skadelige forurenende stoffer til mindre skadelige stoffer.
* nikkel: Brugt i hydrogenering af vegetabilske olier til at producere margarine.
Betydningen af katalysatorer:
* Industrielle processer: Katalysatorer er afgørende i mange industrielle processer, såsom produktion af plast, gødning og brændstoffer.
* miljøbeskyttelse: Katalysatorer bruges i forureningskontrolenheder for at reducere skadelige emissioner.
* Medicinske applikationer: Katalysatorer bruges i lægemiddeludvikling og syntese.
Sammenfattende er en katalysator et kraftfuldt værktøj, der kan ændre hastigheden af kemiske reaktioner markant uden at blive konsumeret i processen. De spiller en vigtig rolle i mange brancher og videnskabelige discipliner.
 Varme artikler
Varme artikler
-
 Den amerikanske gigant Monsanto kendt for kontroversielle kemikalierDet Internationale Agentur for Kræftforskning, en del af FNs Verdenssundhedsorganisation, klassificerede i 2015 Roundups hovedingrediens glyphosat som et sandsynligt kræftfremkaldende stof Fra Age
Den amerikanske gigant Monsanto kendt for kontroversielle kemikalierDet Internationale Agentur for Kræftforskning, en del af FNs Verdenssundhedsorganisation, klassificerede i 2015 Roundups hovedingrediens glyphosat som et sandsynligt kræftfremkaldende stof Fra Age -
 Forskere opdager metode til at forhindre kalkaflejringerTop – Molekylære strukturer af de anvendte additiver med lille MW. Mellem-SEM-billeder af produkterne efter hurtig udfældning i nærvær af tilsætningsstoffer. Alle pulvere var amorfe. Bund – Produkter
Forskere opdager metode til at forhindre kalkaflejringerTop – Molekylære strukturer af de anvendte additiver med lille MW. Mellem-SEM-billeder af produkterne efter hurtig udfældning i nærvær af tilsætningsstoffer. Alle pulvere var amorfe. Bund – Produkter -
 Nogle eksisterende kræftbekæmpende lægemidler kan delvis virke ved at målrette mod RNA, undersø…Professor Matthew Disney ledede den nye undersøgelse. Kredit:Scripps Research Styrker opfattelsen af, at RNA bør betragtes som et vigtigt lægemiddelopdagelsesmål, forskere ved Scripps Research har
Nogle eksisterende kræftbekæmpende lægemidler kan delvis virke ved at målrette mod RNA, undersø…Professor Matthew Disney ledede den nye undersøgelse. Kredit:Scripps Research Styrker opfattelsen af, at RNA bør betragtes som et vigtigt lægemiddelopdagelsesmål, forskere ved Scripps Research har -
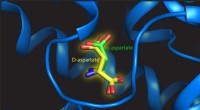 Montering af en højre hånd i en venstrehåndsvanteDenne illustration viser L- og D-aspartat på bindingsstedet for transportproteinet. Kredit:Valentina Arkhipova, University of Groningen Mange biomolekyler findes i to versioner, der er hinandens s
Montering af en højre hånd i en venstrehåndsvanteDenne illustration viser L- og D-aspartat på bindingsstedet for transportproteinet. Kredit:Valentina Arkhipova, University of Groningen Mange biomolekyler findes i to versioner, der er hinandens s
- Hvad er ordligningen for reaktion mellem magnesiummetal og saltsyre?
- Special-temporale mønstre af hydroklimaændringer på det kinesiske Löss-plateau
- Hvad ligner Jordens overflade?
- Hvorfor at stole på ny teknologi vil ikke redde planeten
- Den cellulære transportmekanisme, der afhænger af blodtrykket?
- Hvad er videnskabelig metode i renæssance?


