Hvordan identificeres hvad der oxideres og reduceres?
forståelse af det grundlæggende
* Oxidation: Tabet af elektroner. Et atom eller ion, der mister elektroner, bliver mere positivt ladet.
* reduktion: Gevinsten af elektroner. Et atom eller ion, der får elektroner, bliver mere negativt ladet.
nøglekoncepter
* olieriggen: En nyttig mnemonic at huske: o Xidation i S l OSS af elektroner, r Eduction i S g ain af elektroner.
* Oxidationsnumre: Disse tildeles atomer i molekyler og ioner for at spore elektronoverførsel.
* redoxreaktioner: Reaktioner, hvor oxidation og reduktion forekommer samtidig.
Sådan identificeres oxidation og reduktion
1. Tildel oxidationsnumre:
* Bestem oxidationsnumrene for hvert element i reaktanter og produkter.
* Brug reglerne til tildeling af oxidationsnumre til at hjælpe dig (f.eks. Er ilt normalt -2, alkalimetaller er +1).
2. Se efter ændringer i oxidationsnumre:
* Identificer de elementer, der har ændret deres oxidationsnumre under reaktionen.
* En stigning i oxidationsnummer indikerer oxidation.
* Et fald i oxidationsnummer indikerer reduktion.
3. Eksempel:
Overvej reaktionen:
Zn (s) + Cu²⁺ (aq) → Zn²⁺ (aq) + cu (s)
* reaktanter: Zn har et oxidationsnummer på 0, Cu²⁺ har et oxidationsnummer på +2.
* Produkter: Zn²⁺ har et oxidationsnummer på +2, Cu har et oxidationsnummer på 0.
* Analyse: Zn er blevet oxideret (dets oxidationsnummer steg fra 0 til +2), og Cu²⁺ er reduceret (dets oxidationsnummer faldt fra +2 til 0).
Yderligere tip
* mnemonic: Husk forkortelsen "Leo siger ger" ( l OSS af e Lectrons er o Xidation, g ain af e Lectrons er r Eduction).
* afbalancering af redoxreaktioner: Brug halvreaktionsmetoden til at afbalancere redoxreaktioner. Dette involverer at adskille reaktionen i to halvreaktioner:en til oxidation og en til reduktion.
* Praksis: Jo mere du praktiserer at identificere oxidation og reduktion, jo lettere bliver det. Arbejd gennem forskellige eksempler og kig efter mønstre.
Lad mig vide, om du vil se flere eksempler eller have nogen specifikke reaktioner, du gerne vil analysere!
 Varme artikler
Varme artikler
-
 Bioplast i bæredygtighedsdilemmaetTil dyrkning af sukkerrør, naturlig vegetation omdannes ofte til landbrugsjord og skove fældes. Kredit:OLOURBOX.de Plast fremstillet af afgrøder som majs eller sukkerrør i stedet for fossile brænd
Bioplast i bæredygtighedsdilemmaetTil dyrkning af sukkerrør, naturlig vegetation omdannes ofte til landbrugsjord og skove fældes. Kredit:OLOURBOX.de Plast fremstillet af afgrøder som majs eller sukkerrør i stedet for fossile brænd -
 Kan defekter gøre inaktive materialer til nyttige, aktive?Defekter i gitterstrukturen af hexagonalt bornitrid kan påvises med fotoluminescens. Forskere skinner et lys med en farve eller energi på materialet og får en anden farve fra defekten. Derudover vis
Kan defekter gøre inaktive materialer til nyttige, aktive?Defekter i gitterstrukturen af hexagonalt bornitrid kan påvises med fotoluminescens. Forskere skinner et lys med en farve eller energi på materialet og får en anden farve fra defekten. Derudover vis -
 Forlængelse af fødevarers holdbarhed med nanomaterialerKredit:Ozgur Coskun, Shutterstock Hvornår var sidste gang du blev fristet af lækre kirsebær i dit supermarked eller så, at dit yndlingsmærke af emballeret brød var til salg, og du har grådigt købt
Forlængelse af fødevarers holdbarhed med nanomaterialerKredit:Ozgur Coskun, Shutterstock Hvornår var sidste gang du blev fristet af lækre kirsebær i dit supermarked eller så, at dit yndlingsmærke af emballeret brød var til salg, og du har grådigt købt -
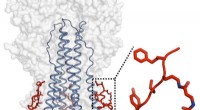 Forskere udvikler bredspektrede hæmmere af influenzavirusJanssen- og TSRI-holdene designede og karakteriserede et potent peptid, der efterlignede funktionaliteten af et bredt neutraliserende antistof, og som også var i stand til at målrette influenzavirus
Forskere udvikler bredspektrede hæmmere af influenzavirusJanssen- og TSRI-holdene designede og karakteriserede et potent peptid, der efterlignede funktionaliteten af et bredt neutraliserende antistof, og som også var i stand til at målrette influenzavirus
- Hvordan identificeres ioniske forbindelser?
- Atomkraftværket lukker uventet ned i staten Washington
- Safirer viser deres sande farver:Ikke vandelskende
- Er dinosaurer ægte? Hvad vi ved om de uddøde skabninger
- Sporing af den største solstorm i moderne tid fra træringe i Lapland
- Hvad er formlen for magnesiumhydrogen tellurate?


