Linjerne i det lyse linjespektrum af et atom skyldes hvad?
Her er en sammenbrud:
* Elektroner i atomer kan kun eksistere ved specifikke energiniveauer. Disse niveauer er kvantiseret, hvilket betyder, at de kun kan påtage sig diskrete værdier.
* Når en elektron bevæger sig fra et højere energiniveau til et lavere, frigiver det energi i form af lys. Energien i det udsendte lys svarer til forskellen i energi mellem de to niveauer.
* Da energiniveauet er kvantiseret, har det udsendte lys specifikke bølgelængder. Dette resulterer i de lyse linjer, der ses i spektret, hver svarende til en bestemt energiniveauovergang.
Kortfattet:
1. ophidsede elektroner: Elektroner er glade for højere energiniveau.
2. Elektronovergange: Elektroner falder tilbage til lavere energiniveau.
3. Lysemission: Energi frigøres som lys med specifikke bølgelængder.
4. lyse linjespektrum: Det udsendte lys skaber et lys linjespektrum, hvor hver linje svarer til en bestemt overgang til energiniveau.
Dette er grunden til, at hvert element har et unikt lyslinjespektrum, som et fingeraftryk, der giver os mulighed for at identificere det.
 Varme artikler
Varme artikler
-
 En visuel database over humane plasmaforbindelserDatabasen er i stand til at kortlægge sammenhængen mellem de forskellige metabolitter, at tilbyde besøgende yderligere forskningsmuligheder. Kredit:Tohoku Medical Megabank Organization Forskere i
En visuel database over humane plasmaforbindelserDatabasen er i stand til at kortlægge sammenhængen mellem de forskellige metabolitter, at tilbyde besøgende yderligere forskningsmuligheder. Kredit:Tohoku Medical Megabank Organization Forskere i -
 Nyudviklede screeningsprocesser vil fremskynde forskning i kulstoffangstArbejdere på Quest kulstoffangst- og lagerfacilitet i Fort Saskatchewan, Alta. U of A-forskere udtænkte en proces, der dramatisk reducerer den tid, det tager at udvikle kulstoffangstteknologier, hvilk
Nyudviklede screeningsprocesser vil fremskynde forskning i kulstoffangstArbejdere på Quest kulstoffangst- og lagerfacilitet i Fort Saskatchewan, Alta. U of A-forskere udtænkte en proces, der dramatisk reducerer den tid, det tager at udvikle kulstoffangstteknologier, hvilk -
 Ingeniører skaber den mest slidstærke metallegering i verdenKredit:Sandia National Laboratories Hvis du nogensinde er så uheldig at have en bil med metaldæk, du kan overveje et sæt fremstillet af en ny legering konstrueret på Sandia National Laboratories.
Ingeniører skaber den mest slidstærke metallegering i verdenKredit:Sandia National Laboratories Hvis du nogensinde er så uheldig at have en bil med metaldæk, du kan overveje et sæt fremstillet af en ny legering konstrueret på Sandia National Laboratories. -
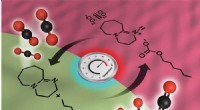 Forskere bekræfter forskellige regioner i populært kulstoffangst og syntese opløsningsmiddelBagsiden af Physical Chemistry Chemical Physics viser et stiliseret billede af de forskellige regioner i SWIL, og hvordan kuldioxiden bevæger sig mellem regionerne baseret på temperatur. Kredit:Mike
Forskere bekræfter forskellige regioner i populært kulstoffangst og syntese opløsningsmiddelBagsiden af Physical Chemistry Chemical Physics viser et stiliseret billede af de forskellige regioner i SWIL, og hvordan kuldioxiden bevæger sig mellem regionerne baseret på temperatur. Kredit:Mike
- Rumstationers datahastighedsstigning understøtter fremtidig udforskning
- Bill sigter mod at bruge milliarder til at reparere nationers ældning af dæmninger
- Ny opdagelse:Almindelige vandmænd er faktisk to arter
- Sydafrikanske kvinder, der har behov for at opgive deres babyer, har ikke sikre muligheder:Dette ska…
- 520 millioner år gammelt ormefossil løser mysteriet om, hvordan moderne insekter, edderkopper og k…
- Onan Motor Information


