Ændrer en stoftemperatur, når den ændrer tilstand?
Her er hvorfor:
* faseændringer kræver energi: Ændring af tilstand involverer at bryde eller danne bindinger mellem molekyler. Dette kræver energiindgang (til smeltning, kogning, sublimering) eller energifrigivelse (til frysning, kondensering, deponering).
* Energi går i skiftende tilstand, ikke temperatur: I stedet for at øge molekylernes kinetiske energi (som vil hæve temperaturen), bruges energien til at overvinde kræfterne, der holder molekylerne sammen i den aktuelle tilstand.
* konstant temperatur under faseændring: Den tilsatte eller frigivne energi bruges udelukkende til at ændre stoffets tilstand, så temperaturen forbliver konstant under faseændringen.
Eksempel: Når is smelter, går den leverede energi til at bryde bindingerne mellem vandmolekyler, hvilket giver dem mulighed for at bevæge sig mere frit som en væske. Temperaturen forbliver ved 0 ° C, indtil al isen er smeltet.
Bemærk: Der er nogle nuancer i denne forklaring, såsom begrebet "latent varme" og ideen om, at meget små temperaturændringer undertiden kan forekomme under en faseændring. Til de fleste praktiske formål forbliver imidlertid temperaturen på et stof konstant under en faseændring.
 Varme artikler
Varme artikler
-
 Den søde smag af succes for en understøttet nikkel -legeringskatalysator af nikkelphosphidKatalytisk hydrogenering af maltose til maltitol. Kredit:Osaka University Katalysatorer er kernen i en grønnere og mere bæredygtig fremtid for kemisk produktion. Imidlertid, mange af de katalysato
Den søde smag af succes for en understøttet nikkel -legeringskatalysator af nikkelphosphidKatalytisk hydrogenering af maltose til maltitol. Kredit:Osaka University Katalysatorer er kernen i en grønnere og mere bæredygtig fremtid for kemisk produktion. Imidlertid, mange af de katalysato -
 Udtrække information fra gamle tænderKredit:CC0 Public Domain Der er en overraskende mængde information gemt i den hærdede plak, eller beregning, mellem tænderne. Og hvis den beregning tilhører resterne af en person, der levede i old
Udtrække information fra gamle tænderKredit:CC0 Public Domain Der er en overraskende mængde information gemt i den hærdede plak, eller beregning, mellem tænderne. Og hvis den beregning tilhører resterne af en person, der levede i old -
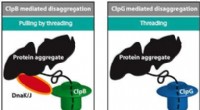 Hvordan folder cellemaskiner fejlfoldede proteiner ud?Kredit:Leiden University Proteinkæder foldes typisk for at fungere. Foldning er en kompleks proces, og hvis det gøres korrekt, fører det til en unik funktionel foldetopologi for en given proteinkæ
Hvordan folder cellemaskiner fejlfoldede proteiner ud?Kredit:Leiden University Proteinkæder foldes typisk for at fungere. Foldning er en kompleks proces, og hvis det gøres korrekt, fører det til en unik funktionel foldetopologi for en given proteinkæ -
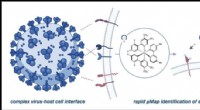 Forskere identificerer flere mulige indgangspunkter for COVID-spidsproteinVærtscelle- og virusgrænsefladen kan være kompleks og involvere mange proteiner, men µMap muliggør direkte undersøgelse af funktionelt vigtige interaktioner. Kredit:Saori Suzuki et al., Journal of the
Forskere identificerer flere mulige indgangspunkter for COVID-spidsproteinVærtscelle- og virusgrænsefladen kan være kompleks og involvere mange proteiner, men µMap muliggør direkte undersøgelse af funktionelt vigtige interaktioner. Kredit:Saori Suzuki et al., Journal of the
- Hvor længe kan et menneske overleve i det ydre rum?
- Hvordan Ben Franklin hjalp med at antænde Jersey Devil Hysteria
- EU opfordrer internetfirmaer til at intensivere kampen om falske nyheder
- Hvad er mængden af vand i luften?
- Hvad er oxidationstallet for O i CaO?
- Forskergruppen kører simuleringer, der er i stand til at beskrive Sydamerikas klima med hidtil uset…


