Hvilke obligationer har carbonatomer en tendens til at danne?
* Valenselektroner: Carbon har fire valenselektroner (elektroner i sin yderste skal). For at opnå en stabil oktet (otte elektroner i sin ydre skal) skal den vinde eller dele fire flere elektroner.
* deling, ikke overførsel: Carbon mister eller får fire elektroner til at blive en ion. I stedet deler den let sine elektroner med andre atomer og danner kovalente bindinger.
* Stærke obligationer: Kovalente bindinger er stærke bindinger dannet ved deling af elektroner mellem atomer. Denne deling skaber en stabil konfiguration for begge involverede atomer.
Typer af kovalente obligationer Kulstofformer:
* enkelt obligationer: Carbon kan dele et elektron med et andet atom, der danner en enkelt kovalent binding.
* dobbeltobligationer: Carbon kan dele to elektroner med et andet atom og danne en dobbelt kovalent binding.
* Triple Bonds: Carbon kan dele tre elektroner med et andet atom og danne en tredobbelt kovalent binding.
Nøglepunkter:
* alsidighed: Evnen til at danne enkelt-, dobbelt- og tredobbeltbindinger giver kulstof en uovertruffen alsidighed til dannelse af en lang række molekyler.
* kædedannelse: Carbon kan forbinde med andre carbonatomer til dannelse af lange kæder, hvilket skaber komplekse strukturer som kulbrinter.
* Filial: Carbon kan danne grene og ringe og udvide mulighederne for molekylstrukturer yderligere.
Eksempler:
* methan (CH4): Carbon danner fire enkeltbindinger med brintatomer.
* ethylen (C2H4): Carbon danner en dobbeltbinding med et andet carbonatom og enkeltbindinger med to hydrogenatomer.
* acetylen (C2H2): Carbon danner en tredobbelt binding med et andet carbonatom og enkeltbindinger med to hydrogenatomer.
Kulstofens evne til at danne stærke kovalente bindinger og dens alsidighed i binding med andre atomer er den grundlæggende årsag bag den utrolige mangfoldighed og kompleksitet af organiske molekyler, der danner grundlaget for livet, som vi kender det.
 Varme artikler
Varme artikler
-
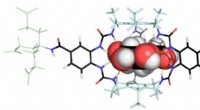 Glucosebindende molekyle kunne transformere behandlingen af diabetesReceptor bindende glucose. Kredit:University of Bristol Forskere fra University of Bristol har designet en ny syntetisk glukosebindende molekyleplatform, der bringer os et skridt tættere på udvikl
Glucosebindende molekyle kunne transformere behandlingen af diabetesReceptor bindende glucose. Kredit:University of Bristol Forskere fra University of Bristol har designet en ny syntetisk glukosebindende molekyleplatform, der bringer os et skridt tættere på udvikl -
 Forskere studerer syntetiske proteinburePakning af proteinbyggesten i sfæriske skaller. Kredit:University of Bristol Et tværfagligt team af matematikere, teoretiske fysikere, kemikere og biokemikere fra University of Bristol gik sammen
Forskere studerer syntetiske proteinburePakning af proteinbyggesten i sfæriske skaller. Kredit:University of Bristol Et tværfagligt team af matematikere, teoretiske fysikere, kemikere og biokemikere fra University of Bristol gik sammen -
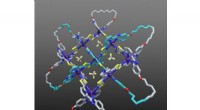 Forskere opdager en ny type molekylær knude ved hjælp af røntgendiffraktionsteknikkerDavid Leigh, University of Manchester. Forskere har udviklet en måde at flette tre molekylære tråde, så det er muligt at lave strammere og mere komplekse knuder, end det tidligere har været muligt
Forskere opdager en ny type molekylær knude ved hjælp af røntgendiffraktionsteknikkerDavid Leigh, University of Manchester. Forskere har udviklet en måde at flette tre molekylære tråde, så det er muligt at lave strammere og mere komplekse knuder, end det tidligere har været muligt -
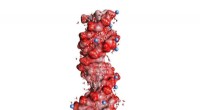 Nye dynamiske sonder til ioner, der interagerer med biomolekylerFig. 1:DNA dobbelt helix indlejret i vand (vinklede små molekyler, ikke i skala). De mørkerøde kugler på helixoverfladen repræsenterer oxygenatomer i de negativt ladede PO2-enheder, de blå kugler posi
Nye dynamiske sonder til ioner, der interagerer med biomolekylerFig. 1:DNA dobbelt helix indlejret i vand (vinklede små molekyler, ikke i skala). De mørkerøde kugler på helixoverfladen repræsenterer oxygenatomer i de negativt ladede PO2-enheder, de blå kugler posi
- Sådan fungerer dampmaskiner
- Nye brudmodstandsmekanismer leveret af grafen
- NOAA-satellitter hjalp med at redde 307 liv i 2016
- Det er vanskeligt at måle mængden af en gas, fordi?
- Thianthrenium-kemi muliggør reaktivitetsskift af en nukleofil aminosyre til et alsidigt mellemprodu…
- Manglende COVID-19-beredskab i overensstemmelse med tidligere resultater, økonomer finder


