Halogen med den mindst-negative elektronaffinitet?
Her er hvorfor:
* Elektronaffinitet er energiændringen, der opstår, når et elektron tilsættes til et neutralt atom i den gasformige tilstand for at danne en negativ ion.
* halogener er gruppe 17 -elementer (også kendt som gruppe VIIA) og har en høj tendens til at få et elektron for at opnå en stabil oktetkonfiguration.
* Når du bevæger dig ned ad halogengruppen, øges atomradius. Dette betyder, at den yderste elektron er længere væk fra kernen og oplever mindre tiltrækning.
* Jo svagere tiltrækningen mellem kernen og den indkommende elektron, desto mindre energi frigives (dvs. jo mindre negativ elektronaffinitet).
Derfor har jod, der er den største halogen, den laveste elektronaffinitet sammenlignet med fluor (F), chlor (CL), brom (BR) og Astatine (AT).
 Varme artikler
Varme artikler
-
 Forskere opnår direkte elektrokatalytisk reduktion af kuldioxid, skaber håb om smart kulstofopsaml…CO2 -reduktionsreaktionen finder sted i det katodiske kammer vist til højre. Kredit: Kemisk videnskab Kemikere ved Tokyo Institute of Technology (Tokyo Tech) har foreslået en innovativ måde at op
Forskere opnår direkte elektrokatalytisk reduktion af kuldioxid, skaber håb om smart kulstofopsaml…CO2 -reduktionsreaktionen finder sted i det katodiske kammer vist til højre. Kredit: Kemisk videnskab Kemikere ved Tokyo Institute of Technology (Tokyo Tech) har foreslået en innovativ måde at op -
 Hvordan klapperslangeskæl hjælper dem med at nippe til regnvand fra deres kroppeKredit:CC0 Public Domain Under storme i det sydvestlige USA, nogle klapperslanger drikker regndråber fra skæl på ryggen. Denne usædvanlige adfærd kunne hjælpe dem med at overleve i et ørkenmiljø m
Hvordan klapperslangeskæl hjælper dem med at nippe til regnvand fra deres kroppeKredit:CC0 Public Domain Under storme i det sydvestlige USA, nogle klapperslanger drikker regndråber fra skæl på ryggen. Denne usædvanlige adfærd kunne hjælpe dem med at overleve i et ørkenmiljø m -
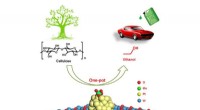 Forskere udvikler en kemokatalytisk tilgang til one-pot-reaktion af celluloseholdig ethanolOne-pot produktion af celluloseholdig ethanol via tandem katalyse over multifunktionel Mo/Pt/WOx katalysator Kredit:WANG Aiqin Forskere ved Dalian Institute of Chemical Physics (DICP) fra det kine
Forskere udvikler en kemokatalytisk tilgang til one-pot-reaktion af celluloseholdig ethanolOne-pot produktion af celluloseholdig ethanol via tandem katalyse over multifunktionel Mo/Pt/WOx katalysator Kredit:WANG Aiqin Forskere ved Dalian Institute of Chemical Physics (DICP) fra det kine -
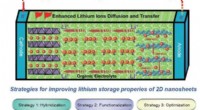 Regulering af todimensionelle nanomaterialer til lithium-ion-batterierStrategier til forbedring af lithiumlagringsegenskaberne for 2D nanoark. Kredit:©Science China Press Li-ion-batterier (LIBer) er fordelagtige energilagringsenheder på grund af deres højere specifi
Regulering af todimensionelle nanomaterialer til lithium-ion-batterierStrategier til forbedring af lithiumlagringsegenskaberne for 2D nanoark. Kredit:©Science China Press Li-ion-batterier (LIBer) er fordelagtige energilagringsenheder på grund af deres højere specifi
- Hvordan grønne alger samler deres enzymer
- Klimaændringer bør hjælpe Midtvestens majsproduktion frem til 2050
- Cryo-EM-billeddannelse antyder, hvordan den dobbelte helix adskilles under replikation
- Hvordan fungerer en transducer i et HVAC-system?
- Galaxy Mrk 335 undersøgt med AstroSat
- Kemikere foreslår ny gavnlig katalysator til indledende materialer i apoteket


