Hvordan kan du forudsige dannelsen af et bundfald i dobbeltudskiftningsreaktion?
1. Skriv den afbalancerede kemiske ligning:
* Identificer reaktanterne og produkterne fra reaktionen.
* Sørg for, at ligningen er afbalanceret ved at justere de støkiometriske koefficienter.
2. Bestem de mulige produkter:
* Brug opløselighedsreglerne til at forudsige opløseligheden af de potentielle produkter.
* opløselighedsregler:
* generelt opløselig:
* Gruppe 1 (Li, Na, K, RB, CS) kationer
* Gruppe 2 (CA, SR, BA) kationer
* Ammonium (NH4+) kation
* Halogener (CL, BR, I) undtagen med Ag+, Pb2+, Hg2^2+
* Sulfater (SO4^2-) undtagen med Sr2+, Ba2+, Pb2+, Ca2+(let opløselig)
* generelt uopløselig:
* Carbonates (CO3^2-)
* Fosfater (PO4^3-)
* Hydroxider (OH-)
* Sulfider (S^2-)
* Oxider (O^2-)
* Undtagelser:
* Der er altid undtagelser fra reglerne, så du skal muligvis konsultere et opløselighedskort for bekræftelse.
3. Identificer bundfaldet:
* Hvis en eller begge de potentielle produkter er uopløseligt i henhold til opløselighedsreglerne, vil det udfælde ud af løsningen som et fast stof.
4. Skriv den nettoioniske ligning (valgfrit):
* Den nettoioniske ligning viser kun de ioner, der deltager i reaktionen, eksklusive tilskuerioner.
Eksempel:
reaktion: Bly (ii) nitrat (aq) + kaliumiodid (aq) →
1. Afbalanceret ligning:
* Pb (NO3) 2 (aq) + 2ki (aq) → Pbi2 (s) + 2kno3 (aq)
2. Mulige produkter:
* PBI2 (bly (II) iodid)
* KNO3 (kaliumnitrat)
3. Udfældning:
* PBI2 er uopløselig i henhold til opløselighedsreglerne (halogenider er generelt opløselige, men bly er en undtagelse).
4. Nettoionisk ligning:
* Pb^2 + (aq) + 2i- (aq) → Pbi2 (s)
Derfor er dannelsen af et gult bundfald (PBI2) indikerer, at der er opstået en dobbeltstatningsreaktion.
 Varme artikler
Varme artikler
-
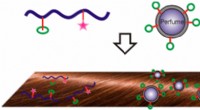 Længerevarende duft er kun en shampoo væk, takket være peptiderKredit:American Chemical Society Mange vælger deres shampoo ud fra lugten. Desværre, den duft holder normalt ikke længe på håret. Nu, et hold melder ind ACS anvendte materialer og grænseflader e
Længerevarende duft er kun en shampoo væk, takket være peptiderKredit:American Chemical Society Mange vælger deres shampoo ud fra lugten. Desværre, den duft holder normalt ikke længe på håret. Nu, et hold melder ind ACS anvendte materialer og grænseflader e -
 Forskere udvikler et værktøj til at undersøge plastadfærd ned til molekylær skalaPrinceton-forskere, herunder ph.d.-studerende Dane Christie, som nu er materialeforsker i Corning, har udviklet et værktøj til at undersøge polymerer på molekylær skala. Kredit:Corning Inc Overvej
Forskere udvikler et værktøj til at undersøge plastadfærd ned til molekylær skalaPrinceton-forskere, herunder ph.d.-studerende Dane Christie, som nu er materialeforsker i Corning, har udviklet et værktøj til at undersøge polymerer på molekylær skala. Kredit:Corning Inc Overvej -
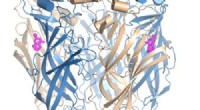 Nye molekylære designs frigør det terapeutiske potentiale af nikotinreceptorerModificerede cytisinmolekyler (fuchsia) bundet til hjernens vigtigste nikotinreceptor. Kredit:Dr. Sofia Oliveira, University of Bristol Syv millioner mennesker dør hvert år af rygerelaterede sygdo
Nye molekylære designs frigør det terapeutiske potentiale af nikotinreceptorerModificerede cytisinmolekyler (fuchsia) bundet til hjernens vigtigste nikotinreceptor. Kredit:Dr. Sofia Oliveira, University of Bristol Syv millioner mennesker dør hvert år af rygerelaterede sygdo -
 Struktur af fedtforarbejdningsenzym bestemtKredit:CC0 Public Domain Efter årtiers arbejde uden succes, forskere har bestemt den høje opløsning, tredimensionel struktur for lipoproteinlipase, enzymet, der behandler fedtstoffer, eller trigly
Struktur af fedtforarbejdningsenzym bestemtKredit:CC0 Public Domain Efter årtiers arbejde uden succes, forskere har bestemt den høje opløsning, tredimensionel struktur for lipoproteinlipase, enzymet, der behandler fedtstoffer, eller trigly
- Indien spænder for cyklon, sætter flåden i alarmberedskab
- Hvilket beskriver bedst jord, der findes i ørkener?
- En international undersøgelse afslører, hvordan genomets 'vogter' fungerer
- Matematikere bag JPEG-filer hædret af spansk pris
- Uorganisk dobbelthelix:En fleksibel halvleder til elektronik, solteknologi og fotokatalyse
- Kvantiseret magneto-elektrisk effekt demonstreret for første gang i topologiske isolatorer


