Funktion af katalysator og hæmmer i reaktionskinetisk?
katalysator og hæmmer i reaktionskinetik
katalysatorer og hæmmere Spil vigtige roller for at påvirke hastigheden for kemiske reaktioner. De gør dette uden at blive fortæret i processen, hvilket betyder, at de kan bruges gentagne gange. Her er en sammenbrud af deres funktioner:
katalysator:
* Definition: Et stof, der øger hastigheden for en kemisk reaktion uden at blive konsumeret i processen.
* mekanisme: Katalysatorer giver en alternativ reaktionsvej med en lavere aktiveringsenergi. Dette betyder, at flere molekyler har nok energi til at reagere ved en given temperatur, hvilket fører til en hurtigere reaktionshastighed.
* Effekt på reaktionskinetik:
* Nedre aktiveringsenergi (EA): Dette er det vigtigste aspekt af katalyse. En lavere EA resulterer i en hurtigere hastighedskonstant (K) i henhold til Arrhenius -ligningen.
* øget reaktionshastighed: På grund af den sænkede EA fortsætter reaktionen hurtigere ved en given temperatur.
* Ingen ændring i ligevægtskonstant (K): Katalysatorer påvirker ikke ligevægtens position, kun den hastighed, hvormed den er nået.
Eksempler:
* enzymer: Biologiske katalysatorer, der fremskynder specifikke biokemiske reaktioner inden for levende organismer.
* metalkatalysatorer: Brugt i forskellige industrielle processer som Haber-Bosch-processen til ammoniaksyntese.
Inhibitor:
* Definition: Et stof, der bremser ned eller forhindrer en kemisk reaktion.
* mekanisme:
* blokering af det aktive sted: Inhibitorer kan binde til det aktive sted for en katalysator og forhindre, at det interagerer med reaktanterne.
* Ændring af katalysatorens struktur: Inhibitorer kan ændre katalysatorens struktur og gøre den mindre effektiv.
* reagerer med reaktanter: Inhibitorer kan reagere med reaktanter og fjerne dem fra reaktionsblandingen.
* Effekt på reaktionskinetik:
* øget aktiveringsenergi (EA): Inhibitorer hæver generelt aktiveringsenergien og bremser reaktionen.
* Nedsat reaktionshastighed: Reaktionen fortsætter langsommere ved en given temperatur på grund af den højere EA.
* Ingen ændring i ligevægtskonstant (K): I lighed med katalysatorer skifter hæmmere ikke ligevægtspunktet, kun den hastighed, hvorpå det er nået.
Eksempler:
* antioxidanter: Inhiberer oxidationsreaktioner, der forårsager ødelæggelse i mad.
* Korrosionsinhibitorer: Forhindre metaloverflader i at rustne eller korrodere.
Nøgleforskelle:
| Funktion | Katalysator | Inhibitor |
| ---------------- | ---------- | ---------- |
| Effekt på hastighed | Øges | Falder |
| Effekt på EA | Falder | Øges |
| Effekt på k | Ingen ændring | Ingen ændring |
| Forbrug | Ikke konsumeret | Ikke konsumeret |
Kortfattet: Katalysatorer fremskynder reaktionerne ved at tilvejebringe alternative veje med lavere aktiveringsenergier, mens hæmmere bremser reaktionerne ved at øge aktiveringsenergien eller blokere aktive steder. Begge spiller betydelige roller i kontrollerende reaktionshastigheder og har vidtrækkende applikationer inden for forskellige felter.
 Varme artikler
Varme artikler
-
 Supramolekylært klæbemiddel med anvendeligt temperaturområde på 400 grader CelsiusKredit:Wiley Forskere har udviklet et supramolekylært klæbemiddel, der er genanvendeligt og har fremragende limegenskaber på tværs af en lang række temperaturer, fra flydende nitrogen (−196 grader
Supramolekylært klæbemiddel med anvendeligt temperaturområde på 400 grader CelsiusKredit:Wiley Forskere har udviklet et supramolekylært klæbemiddel, der er genanvendeligt og har fremragende limegenskaber på tværs af en lang række temperaturer, fra flydende nitrogen (−196 grader -
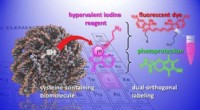 Nye kemiske værktøjer til at modificere og studere biomolekylerEn illustration af den kemiske reaktion udviklet i undersøgelsen. Kredit:J. Waser/B. Fierz (EPFL) Forståelse af strukturen og metabolismen af celler og levende organismer er afgørende for udvikl
Nye kemiske værktøjer til at modificere og studere biomolekylerEn illustration af den kemiske reaktion udviklet i undersøgelsen. Kredit:J. Waser/B. Fierz (EPFL) Forståelse af strukturen og metabolismen af celler og levende organismer er afgørende for udvikl -
 Her er et twist til en ældgammel klassiker:Laktosefri chokolademælkTo nordøstlige kandidater har bragt skifer, deres mærke af laktosefri chokolademælk, på hylderne i mere end 300 dagligvarebutikker langs østkysten. Kredit:Matthew Modoono/Northeastern University F
Her er et twist til en ældgammel klassiker:Laktosefri chokolademælkTo nordøstlige kandidater har bragt skifer, deres mærke af laktosefri chokolademælk, på hylderne i mere end 300 dagligvarebutikker langs østkysten. Kredit:Matthew Modoono/Northeastern University F -
 Forskere udvikler materiale, der kan regenerere tandemaljenNærbillede af det emaljeagtige materiale. Kredit:Alvaro Mata Forskere ved Queen Mary University of London har udviklet en ny måde at dyrke mineraliserede materialer på, som kan regenerere hårdt væ
Forskere udvikler materiale, der kan regenerere tandemaljenNærbillede af det emaljeagtige materiale. Kredit:Alvaro Mata Forskere ved Queen Mary University of London har udviklet en ny måde at dyrke mineraliserede materialer på, som kan regenerere hårdt væ
- Ændring af variabel i ligning, der bruges til at projektere klimaændringer for at give et mere præ…
- Gaza pumper spildevand direkte i havet, efterhånden som krisen forværres
- Ny enhed øger effektiviteten og reducerer omkostningerne ved telekommunikationssatellitter
- Hvordan dannes stående bølge?
- Hvorfor ser vi så mange hajer? Hvornår er det OK at jage dem?
- Hvor i naturen findes enzymer?


