Har du to valenselektroner og kommer til en stabil elektronkonfiguration ved hjælp af elektroner?
* Hvad er valenselektroner? Valenselektroner er elektronerne i det yderste energiniveau af et atom. Det er dem, der er involveret i kemisk binding.
* stabil elektronkonfiguration: Atomer stræber efter at have et fuldt yderste energiniveau, der betragtes som stabil. For de fleste elementer betyder det at have 8 elektroner i deres yderste skal ("Octet -reglen").
* Hvordan gruppe 2 -elementer opnår stabilitet: Gruppe 2 -elementer har to valenselektroner. For at opnå en stabil konfiguration har de en tendens til at miste Disse to elektroner bliver positivt ladede ioner med en +2 ladning. Dette efterlader dem med elektronkonfigurationen af den ædle gas i den foregående periode, som har en fuld ydre skal.
Eksempel:Beryllium (BE)
* Beryllium har et atomnummer på 4, hvilket betyder, at det har 4 elektroner. Dens elektronkonfiguration er 1S² 2S².
* Det har to valenselektroner i 2'erne orbital.
* Beryllium mister disse to elektroner for at blive²⁺⁺, som har den samme elektronkonfiguration som helium (1S²). Helium har en fuld ydre skal og er stabil.
Kortfattet: Gruppe 2 -elementer opnår en stabil elektronkonfiguration ved at miste deres to valenselektroner til dannelse af +2 ioner. Denne proces involverer ofte reaktion med andre elementer til dannelse af ioniske forbindelser.
 Varme artikler
Varme artikler
-
 Forskere udvikler boblediameter forudsigelsesmodel til industriel brug(a) Typisk billeddannelsesbillede; (b) Rationel validering af den foreslåede forudsigelseskorrelation. Kredit:HUANG Qingshan Gas-væske og gas-væske-fast reaktorer er blevet brugt i vid udstrækning
Forskere udvikler boblediameter forudsigelsesmodel til industriel brug(a) Typisk billeddannelsesbillede; (b) Rationel validering af den foreslåede forudsigelseskorrelation. Kredit:HUANG Qingshan Gas-væske og gas-væske-fast reaktorer er blevet brugt i vid udstrækning -
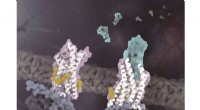 Kemokinreceptor CX3CR1-strukturer afslører mekanisme for kolesterolregulering ved aktiveringStrukturerne af CX3CR1 i distinkte konformationelle tilstande. CX3CR1 i både ligandfri tilstand og CX3CL1-bundet tilstand er farvet hvid. CX3CL1 er farvet cyan, kolesterolerne er farvet gule og de tre
Kemokinreceptor CX3CR1-strukturer afslører mekanisme for kolesterolregulering ved aktiveringStrukturerne af CX3CR1 i distinkte konformationelle tilstande. CX3CR1 i både ligandfri tilstand og CX3CL1-bundet tilstand er farvet hvid. CX3CL1 er farvet cyan, kolesterolerne er farvet gule og de tre -
 Fremtiden for elektronik er elastiskKredit:Yale School of Engineering and Applied Science Strækbare elektroniske kredsløb er afgørende for blød robotteknologi, bærbare teknologier, og biomedicinske applikationer. De nuværende måder
Fremtiden for elektronik er elastiskKredit:Yale School of Engineering and Applied Science Strækbare elektroniske kredsløb er afgørende for blød robotteknologi, bærbare teknologier, og biomedicinske applikationer. De nuværende måder -
 Cementfri beton slår korrosion og giver fatbergs skylEt fatberg udstillet i Melbourne Museum. Kredit:Copyright Museums Victoria, Fotograf:Rob Zugaro Forskere fra RMIT University har udviklet en miljøvenlig nul-cementbeton, hvilket næsten eliminerer
Cementfri beton slår korrosion og giver fatbergs skylEt fatberg udstillet i Melbourne Museum. Kredit:Copyright Museums Victoria, Fotograf:Rob Zugaro Forskere fra RMIT University har udviklet en miljøvenlig nul-cementbeton, hvilket næsten eliminerer
- Afrodisiaka, hvordan virker
- 10 fantastiske grønne byer
- En kraftig solstorm ramte Jorden tilbage i 1582
- En flaske PBSO4 indeholder 158,1 g forbindelsen. Hvor mange mol er der i flaske?
- Hvad omdanner organisk nitrogen til atmosfærisk nitrogen?
- Hvorfor var Vestaustralien uforberedt på katastrofale oversvømmelser?


