Hvad er forskellen mellem koncentreret løsning og opløselighed?
Koncentration
* Definition: Et mål for mængden af opløst stof opløst i en given mængde opløsningsmiddel eller opløsning.
* enheder: Kan udtrykkes på forskellige måder, såsom:
* Molaritet (M): Mol opløst stof pr. Liter opløsning.
* molalitet (m): Mol opløst stof pr. Kg opløsningsmiddel.
* masseprocent (%): Massen af opløst stof divideret med masse af opløsning, ganget med 100.
* dele pr. million (ppm) eller dele pr. milliard (ppb): Forhold, der angiver mængden af opløst stof i en løsning.
* Eksempler:
* En opløsning med en høj koncentration af sukker er meget sød.
* En opløsning med en lav koncentration af salt smager intetsigende.
opløselighed
* Definition: Den maksimale mængde af et opløst stof, der kan opløses i en given mængde opløsningsmiddel ved en bestemt temperatur og tryk.
* enheder: Typisk udtrykt i gram opløst stof pr. 100 gram opløsningsmiddel (G/100G).
* faktorer, der påvirker opløselighed:
* Temperatur: Generelt øges opløseligheden med temperaturen.
* tryk: Opløselighed af gasser øges med tryk.
* arten af opløst stof og opløsningsmiddel: Polære opløste stoffer opløses bedst i polære opløsningsmidler (som vand), og ikke -polære opløste stoffer opløses bedst i ikke -polære opløsningsmidler (som olie).
* Eksempel: Opløseligheden af sukker i vand ved stuetemperatur er ca. 200 g/100 g. Dette betyder, at du kan opløse op til 200 gram sukker i 100 gram vand.
Nøgleforskelle:
* Koncentration er et mål for, hvor meget opløst
* En løsning kan koncentreres eller fortyndes, men dens opløselighed forbliver konstant ved en given temperatur og tryk.
* opløselighed er en egenskab ved opløsningsmiddel og opløsningsmiddel, mens koncentrationen er en egenskab ved løsningen.
Analogi:
Tænk på opløselighed som en beholders kapacitet og koncentration som mængden af væske, der faktisk er i beholderen. Du kan have en beholder med en stor kapacitet (høj opløselighed), men kun delvist fyldt med væske (lav koncentration). Eller du kan have en beholder med en mindre kapacitet (lav opløselighed), men fyldt til randen (høj koncentration).
 Varme artikler
Varme artikler
-
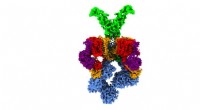 Forskere løser 3-D struktur af nanomaskine, der gør tuberkulose virulent3D-struktur af T7SS-sekretionssystemet af bakterien Mycobacterium smegmatis, svarende til den, som tuberkulosebakterien bruger under infektion. De forskellige proteiner, der udgør denne nanomaskine, e
Forskere løser 3-D struktur af nanomaskine, der gør tuberkulose virulent3D-struktur af T7SS-sekretionssystemet af bakterien Mycobacterium smegmatis, svarende til den, som tuberkulosebakterien bruger under infektion. De forskellige proteiner, der udgør denne nanomaskine, e -
 Team udvikler verdens første test på stedet for syntetiske krydderierPrototypetesten tager kun fem minutter at søge efter krydderi i en spytprøve. Kredit:University of Bath En simpel spyttest til at afsløre, om nogen for nylig har taget gadestoffet spice er blevet
Team udvikler verdens første test på stedet for syntetiske krydderierPrototypetesten tager kun fem minutter at søge efter krydderi i en spytprøve. Kredit:University of Bath En simpel spyttest til at afsløre, om nogen for nylig har taget gadestoffet spice er blevet -
 Nyligt forbedret glasglas gør mikroskoper til termometreEt foto af eksperimentet med et objektglas med den nye belægning. Kredit:University at Buffalo Det ydmyge mikroskopobjektglas i glas kan primes til en makeover. En undersøgelse offentliggjort onl
Nyligt forbedret glasglas gør mikroskoper til termometreEt foto af eksperimentet med et objektglas med den nye belægning. Kredit:University at Buffalo Det ydmyge mikroskopobjektglas i glas kan primes til en makeover. En undersøgelse offentliggjort onl -
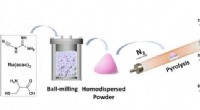 Nye enkelt-atom katalyse støvler reduktiv amineringsreaktionSkematisk illustration til fremstilling af Ru1/NC-T katalysatorer. Kredit:DICP Den geometriske isolering af metalarter i single-atom catalyse (SACer) maksimerer ikke kun atomudnyttelseseffektivite
Nye enkelt-atom katalyse støvler reduktiv amineringsreaktionSkematisk illustration til fremstilling af Ru1/NC-T katalysatorer. Kredit:DICP Den geometriske isolering af metalarter i single-atom catalyse (SACer) maksimerer ikke kun atomudnyttelseseffektivite


