Hvordan danner en krystal krystal?
1. Løsningsdannelse:
* opløste: Det begynder med et stof, der opløses i et opløsningsmiddel, typisk vand. Dette skaber en opløsning, hvor stoffets molekyler spredes jævnt.
* mættet løsning: Efterhånden som der tilføjes mere stof til opløsningen, når det et punkt, hvor ikke mere kan opløses, kendt som mætningspunktet.
* overmætning: Når opløsningen afkøles, eller opløsningsmidlet fordamper, øges koncentrationen af det opløste stof ud over mætningspunktet, hvilket skaber en overmættet opløsning. Det er her magien sker.
2. Nucleation:
* frøkrystaller: Overmættede løsninger er ustabile. Små partikler, kaldet frøkrystaller, kan fungere som udgangspunkt for krystalvækst. Disse frø kan være urenheder i opløsningen, støvpartikler eller endda ridser på beholderen.
* stabile kerner: Når nok molekyler af det opløste stof samles omkring frøkrystallen, danner de en stabil kerne.
3. Krystalvækst:
* attraktion: Molekylerne i den overmættede opløsning tiltrækkes af den voksende krystalgitter. Denne attraktion skyldes de elektrostatiske kræfter og geometriske arrangement af atomer i krystallen.
* Bestilt arrangement: Når molekylerne binder sig til kernen, arrangerer de sig i et specifikt, gentagende mønster. Dette mønster bestemmer formen på krystallen.
* ligevægt: Væksten fortsætter, indtil opløsningen ikke længere er overmættet. En ligevægt er nået, hvor hastigheden af molekyler, der forlader krystalgitteret for at opløse tilbage i opløsningen, er lig med hastigheden af molekyler, der er fastgjort til krystallen.
Faktorer, der påvirker krystaldannelse:
* Temperatur: Lavere temperaturer fremmer generelt krystallisation, da opløseligheden af de fleste stoffer falder med faldende temperatur.
* opløsningsmiddel: Den anvendte opløsningsmiddel kan påvirke krystalstørrelse og -form.
* urenheder: Urenheder i opløsningen kan påvirke nukleationsprocessen og den resulterende krystalmorfologi.
* kølehastighed: En langsommere kølehastighed giver mulighed for større, mere velformede krystaller, mens hurtig afkøling fører til mindre, mindre veldefinerede krystaller.
* omrøring: Røring kan forhindre overmætning og hæmme krystalvækst.
Eksempler på krystallisation:
* saltdannelse: Når havvand fordamper, når de opløste salte overmætning, hvilket fører til dannelse af saltkrystaller.
* Rock Candy: Sukker opløses i vand, og når opløsningen langsomt afkøles, dannes sukkerkrystaller.
* ædelsten: Mange dyrebare ædelstene, som diamanter, smaragder og rubiner, dannes gennem krystallisationsprocesser dybt inde i jorden.
At forstå principperne for krystallisation er afgørende inden for forskellige områder, herunder kemi, materialevidenskab og geologi. Det giver os mulighed for at kontrollere dannelsen af krystaller med ønskede egenskaber, hvilket fører til fremskridt i materialer som lægemidler, halvledere og optiske enheder.
Sidste artikelHvordan reagerer nitrogen med HCL?
Næste artikelHvorfor arbejder kemiker med mol af individuelle atomer?
 Varme artikler
Varme artikler
-
 Beetle-vægte holder hemmeligheden bag at skabe bæredygtig maling af genbrugsplastik, forskning vis…Foto af to cyphochilus biller. Kredit:Olimpia1lli - CC BY-SA 4.0 Strukturen af ultrahvide billevægte kunne være nøglen til at fremstille lyshvid bæredygtig maling ved hjælp af genbrugsplastikaff
Beetle-vægte holder hemmeligheden bag at skabe bæredygtig maling af genbrugsplastik, forskning vis…Foto af to cyphochilus biller. Kredit:Olimpia1lli - CC BY-SA 4.0 Strukturen af ultrahvide billevægte kunne være nøglen til at fremstille lyshvid bæredygtig maling ved hjælp af genbrugsplastikaff -
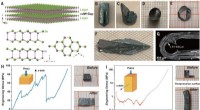 Forskere finder, at krystaller af indiumselenid har enestående fleksibilitetDeformerbarhed af InSe enkeltkrystaller. (A) Krystalstruktur af β-InSe og projektionen på (110) og (001) planerne. (B) Som-vokset krystal og (C) spaltningsoverflade. (D til F) InSe enkeltkrystal omdan
Forskere finder, at krystaller af indiumselenid har enestående fleksibilitetDeformerbarhed af InSe enkeltkrystaller. (A) Krystalstruktur af β-InSe og projektionen på (110) og (001) planerne. (B) Som-vokset krystal og (C) spaltningsoverflade. (D til F) InSe enkeltkrystal omdan -
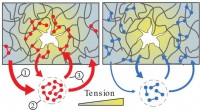 Udforsker, hvordan celler kan være stærke på det rigtige sted og på det rigtige tidspunktCatch bonds (rød) er svage i områder med lav spænding (1) og løsner derfor hurtigt (2). Disse ubundne binder igen på tilfældige steder i netværket, men binder kun tæt i højspændte områder (3), og fors
Udforsker, hvordan celler kan være stærke på det rigtige sted og på det rigtige tidspunktCatch bonds (rød) er svage i områder med lav spænding (1) og løsner derfor hurtigt (2). Disse ubundne binder igen på tilfældige steder i netværket, men binder kun tæt i højspændte områder (3), og fors -
 TNT kan gå på pension efter 116 år på jobbetSprængstofkemiker David Chavez hælder et eksempel på smeltestøbt sprængstof i en kobberform ved Los Alamos National Laboratorys Technical Area 9. Kredit:LANL Forskere ved Los Alamos National Labor
TNT kan gå på pension efter 116 år på jobbetSprængstofkemiker David Chavez hælder et eksempel på smeltestøbt sprængstof i en kobberform ved Los Alamos National Laboratorys Technical Area 9. Kredit:LANL Forskere ved Los Alamos National Labor


