Hvorfor er inerte gasser altid stabile?
Her er hvorfor:
* Elektronkonfiguration: Atomer stræber efter at opnå en stabil, lavenergi-konfiguration som de ædle gasser. Denne stabilitet opnås, når deres yderste elektronskal (Valence Shell) er fuldstændigt fyldt.
* octet regel: For de fleste elementer indeholder en fuld valensskal otte elektroner ("Octet -reglen").
* inerte gasser og oktetreglen: Inerte gasser har naturligvis en fuld ydre skal. For eksempel har helium 2 elektroner (dens eneste skal er fuld), neon har 10 elektroner (2 i den første skal, 8 i den anden), og argon har 18 elektroner (2, 8, 8).
Hvorfor fremstiller en fuld ydre skal et atomstall?
* Kemisk binding: Atomer danner bindinger for at opnå stabilitet. De mister enten, vinder eller deler elektroner for at nå en fuld ydre skal.
* Ingen tendens til at reagere: Da inerte gasser allerede har en fuld ydre skal, har de ikke behov for at vinde eller miste elektroner. Dette gør dem utroligt ureaktive og stabile.
Undtagelser:
Mens de fleste ædle gasser er ekstremt ureaktive, kan nogle tungere ædle gasser som xenon og radon danne forbindelser under meget specifikke betingelser på grund af deres store atomstørrelse og relativt svage greb på deres ydre elektroner.
Kortfattet: Inerte gasser er stabile, fordi deres fulde ydre elektronskaller gør dem kemisk ureaktive. De behøver ikke at vinde eller miste elektroner for at opnå stabilitet i modsætning til andre elementer.
Sidste artikelHvad er formlen for ionisk sammensat boriodid?
Næste artikelHvilken type binding har høj elektronegativitet?
 Varme artikler
Varme artikler
-
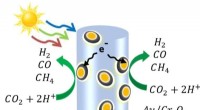 Soldrevet kemi bruger kuldioxid og vand til at fremstille råmaterialer til brændstoffer, kemikalie…Et diagram over halvledernannotrådene lavet af indium, gallium og nitrogen - dekoreret med guld- og kromoxidnanopartikler. Når lyset rammer nanotråden, frigør det elektroner og de positivt ladede hull
Soldrevet kemi bruger kuldioxid og vand til at fremstille råmaterialer til brændstoffer, kemikalie…Et diagram over halvledernannotrådene lavet af indium, gallium og nitrogen - dekoreret med guld- og kromoxidnanopartikler. Når lyset rammer nanotråden, frigør det elektroner og de positivt ladede hull -
 Forskere opnår gennembrud i 3-D trykt rustfrit stål af marin kvalitetLLNL -materialeforsker Joe McKeown ser på, da postdoc -forsker Thomas Voisin undersøger en prøve af 3D -trykt rustfrit stål. Kredit:Kate Hunts/LLNL Rustfrit stål af marin kvalitet er værdsat for s
Forskere opnår gennembrud i 3-D trykt rustfrit stål af marin kvalitetLLNL -materialeforsker Joe McKeown ser på, da postdoc -forsker Thomas Voisin undersøger en prøve af 3D -trykt rustfrit stål. Kredit:Kate Hunts/LLNL Rustfrit stål af marin kvalitet er værdsat for s -
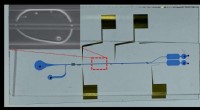 Mikrofluidisk system med celleadskillende kræfter kan afsløre, hvordan nye patogener angriberEt billede af den in-dråbe celleadskillelse mikrofluidisk chip, viser de mikrofluidiske kanaler og elektroder. Forstørret billede viser en værtscelle og patogene bakterieceller, der adskilles til top
Mikrofluidisk system med celleadskillende kræfter kan afsløre, hvordan nye patogener angriberEt billede af den in-dråbe celleadskillelse mikrofluidisk chip, viser de mikrofluidiske kanaler og elektroder. Forstørret billede viser en værtscelle og patogene bakterieceller, der adskilles til top -
 Perfekte drikkevarer og flydende mad ned til molekylært niveauKredit:billede 1, Shutterstock Bartendere og cocktailentusiaster ved det:proportioner betyder noget. Lidt for meget eller lidt for lidt af en ingrediens, og den person, der drikker, vil aldrig se
Perfekte drikkevarer og flydende mad ned til molekylært niveauKredit:billede 1, Shutterstock Bartendere og cocktailentusiaster ved det:proportioner betyder noget. Lidt for meget eller lidt for lidt af en ingrediens, og den person, der drikker, vil aldrig se
- Forskere gør potentielt gennembrud inden for udvikling af kræftlægemidler
- Hvornår kan det yngste lag i et sæt sedimentær klippe ikke være på toppen?
- Hvorfor ændrer en stjerne sig over tid?
- Elon Musk har ikke et bord til at se ham, når han tager Twitter privat. Betyder det noget?
- Hvilke klasser af biologiske makromolekyler, som enzymer og stivelse tilhører?
- Top-down design bringer nye DNA-strukturer til live


