Hvorfor opløses phenol ikke i vand, når det er overskydende?
Her er hvorfor:
* Polaritet: Phenol har en polær hydroxylgruppe (-OH), som kan danne hydrogenbindinger med vandmolekyler. Dette bidrager til dens opløselighed.
* ikke -polaritet: Phenol har imidlertid også en stor ikke -polær aromatisk ring. Denne ikke -polære del er ikke så let opløselig i vand.
Balancen mellem disse to faktorer bestemmer opløseligheden af phenol.
* Begrænset opløselighed: Mens phenol kan danne hydrogenbindinger med vand, reducerer den ikke -polariske rings ikke -polaritet sin overordnede polaritet. Dette gør det kun lidt opløseligt i vand, især ved højere koncentrationer.
* overskydende phenol: Når du tilsætter overskydende phenol, kan vandmolekylerne kun danne brintbindinger med et begrænset antal phenolmolekyler. De overskydende phenolmolekyler, med deres overvejende ikke -polære karakter, klump sammen og adskiller sig fra vandet, hvilket danner et tydeligt lag.
Derfor udviser phenol en begrænset opløselighed i vand, og tilføjelse af et overskydende fører til faseseparation på grund af de konkurrerende polære og ikke -polære interaktioner.
 Varme artikler
Varme artikler
-
 Olivenmøllens spildevand omdannet:Fra forurenende stof til biogødning, biobrændstofKredit:American Chemical Society Olivenolie har længe været et populært køkkenprodukt. Men produktionen af olien skaber en stor strøm af spildevand, der kan forurene vandveje, reducere jordens f
Olivenmøllens spildevand omdannet:Fra forurenende stof til biogødning, biobrændstofKredit:American Chemical Society Olivenolie har længe været et populært køkkenprodukt. Men produktionen af olien skaber en stor strøm af spildevand, der kan forurene vandveje, reducere jordens f -
 Genoplivende kvasikrystaller:Fund gør et eksotisk materiale kommercielt levedygtigtKredit:CC0 Public Domain En klasse af materialer, der engang så ud, som om den kunne revolutionere alt fra solceller til stegepander - men faldt i unåde i begyndelsen af 2000erne - kunne være kl
Genoplivende kvasikrystaller:Fund gør et eksotisk materiale kommercielt levedygtigtKredit:CC0 Public Domain En klasse af materialer, der engang så ud, som om den kunne revolutionere alt fra solceller til stegepander - men faldt i unåde i begyndelsen af 2000erne - kunne være kl -
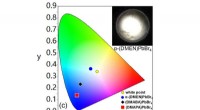 Ændring af den interne struktur af 2-D hybrid perovskit materialer får dem til at udsende hvidt ly…Farvekoordinatkortet illustrerer lysets farver, der udsendes af forskellige hybridperovskitter (med varierende grader af intern strukturel forvrængning) i forhold til ren hvid (svarende til den gule c
Ændring af den interne struktur af 2-D hybrid perovskit materialer får dem til at udsende hvidt ly…Farvekoordinatkortet illustrerer lysets farver, der udsendes af forskellige hybridperovskitter (med varierende grader af intern strukturel forvrængning) i forhold til ren hvid (svarende til den gule c -
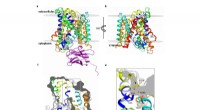 Karakterisering af strukturen af et medlem af L-Aminosyre Transporter (LAT) familienBasC transporterens opbygning. Kredit:Manuel Paladín, IRB Barcelona Hos mennesker, der er mere end 50 typer aminosyretransportører, som er ansvarlige for den cellulære optagelse af aminosyrer og f
Karakterisering af strukturen af et medlem af L-Aminosyre Transporter (LAT) familienBasC transporterens opbygning. Kredit:Manuel Paladín, IRB Barcelona Hos mennesker, der er mere end 50 typer aminosyretransportører, som er ansvarlige for den cellulære optagelse af aminosyrer og f


