Hvilken polyatomisk ion danner en neutral forbindelse, når den kombineres med gruppe 1A monatomisk i forholdet 1 2?
forståelse af det grundlæggende
* gruppe 1A (alkalimetaller): Disse elementer har en +1 ladning, når de danner ioner (f.eks. Na+, K+, Li+).
* polyatomiske ioner: Dette er grupper af atomer, der fungerer som en enkelt enhed med en bestemt ladning.
* neutral forbindelse: En forbindelse med en nettoopladning på nul.
Logikken
For at danne en neutral forbindelse med et forhold på 1:2 (en gruppe 1A -ion til to polyatomiske ioner) skal den polyatomiske ion have en -1 -ladning. Dette er fordi:
* En +1 ladning fra gruppe 1aion
* To -1 afgifter fra de polyatomiske ioner
* +1 + (-1) + (-1) =0 (en neutral forbindelse)
Eksempler
Almindelige polyatomiske ioner med en -1 -ladning inkluderer:
* hydroxid (OH-)
* nitrat (NO3-)
* bicarbonat (HCO3-)
Konklusion
Enhver polyatomisk ion med en -1 -ladning vil danne en neutral forbindelse med en gruppe 1A monatomisk ion i et forhold på 1:2. Eksempler inkluderer:
* NaOH (natriumhydroxid)
* KNO3 (kaliumnitrat)
* Lihco3 (lithium bicarbonat)
Sidste artikelHvad er den kemiske formel for allose?
Næste artikelHvorfor bruger du kalium til at fremstille chlorid?
 Varme artikler
Varme artikler
-
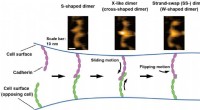 Visualisering af bindingsprocesser af celle-celle-adhæsionsmolekyler i opløsningHS-AFM billeder af cadherin dimererne er vist øverst. Bindingsmekanismen for cadheriner er illustreret i bunden baseret på HS-AFM-observationer. Kredit:Shigetaka Nishiguchi fra videnskabsmænd ved Expl
Visualisering af bindingsprocesser af celle-celle-adhæsionsmolekyler i opløsningHS-AFM billeder af cadherin dimererne er vist øverst. Bindingsmekanismen for cadheriner er illustreret i bunden baseret på HS-AFM-observationer. Kredit:Shigetaka Nishiguchi fra videnskabsmænd ved Expl -
 Samling af komplekse molekylerNukleosider er grundlæggende byggesten i genetisk materiale, hvilket gør dem attraktive til en række biologisk relevante anvendelser og som potentielle lægemidler. På City College i New York, forskere
Samling af komplekse molekylerNukleosider er grundlæggende byggesten i genetisk materiale, hvilket gør dem attraktive til en række biologisk relevante anvendelser og som potentielle lægemidler. På City College i New York, forskere -
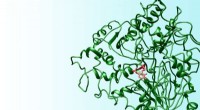 Ny aminosyre kan føre til fremskridt på alvorlige sygdommeEn gengivelse af en ny aminosyre (grøn) skabt af Nebraska-kemikere. Forskerne viste, at aminosyren kan inaktivere en type enzym (rødt) forbundet med Parkinsons sygdom, epilepsi og andre helbredsproble
Ny aminosyre kan føre til fremskridt på alvorlige sygdommeEn gengivelse af en ny aminosyre (grøn) skabt af Nebraska-kemikere. Forskerne viste, at aminosyren kan inaktivere en type enzym (rødt) forbundet med Parkinsons sygdom, epilepsi og andre helbredsproble -
 Forebyggelse, helbredende huller i tænderne med et bioaktivt peptidKredit:CC0 Public Domain hulrum, eller caries, er den mest udbredte ikke-smitsomme sygdom globalt, ifølge Verdenssundhedsorganisationen. At få boret og fyldt et hulrum på tandlægens kontor kan vær
Forebyggelse, helbredende huller i tænderne med et bioaktivt peptidKredit:CC0 Public Domain hulrum, eller caries, er den mest udbredte ikke-smitsomme sygdom globalt, ifølge Verdenssundhedsorganisationen. At få boret og fyldt et hulrum på tandlægens kontor kan vær
- Hvilket grundstof afviger fra tendensen i ioniseringsenergi over periode 2?
- Hvad ville der ske, hvis der ikke var nogen minedrift i Antarktis?
- Forbedret luftkvalitet under den første bølge af COVID forhindrede 150 for tidlige dødsfald i stø…
- Patentanmeldt miljøvenlig proces til fremstilling af nanosfærer
- Hvorfor brænder is og salt sammen huden?
- Efter eBay forbedrede sin oversættelsessoftware, international handel steg kraftigt


