Er der en katalysator, der bruges til reaktion?
* katalysatorer fremskynder reaktioner: De giver en alternativ reaktionsvej med en lavere aktiveringsenergi, hvilket får reaktionen til at ske hurtigere.
* de forbliver uændrede: Katalysatorer forbruges ikke i reaktionen. De deltager i reaktionsmekanismen, men regenereres i deres oprindelige form i slutningen.
Tænk på det sådan: Forestil dig en katalysator som matchmaker. De bringer reaktanter sammen, så de kan reagere hurtigere, men matchmakeren selv ændrer sig ikke i processen. De kan fortsætte med at lave flere kampe.
Eksempel: I nedbrydningen af hydrogenperoxid (H₂O₂) fungerer mangandioxid (MNO₂) som en katalysator. Reaktionen er:
2H₂O₂ → 2H₂O + O₂
Mno₂ fremskynder reaktionen, men forbruges ikke. Det kan gendannes, når reaktionen er afsluttet.
Vigtig note: Mens katalysatorer ikke bruges i reaktionen, kan de deaktiveres af forskellige faktorer som forgiftning (forurenende stoffer), ændringer i temperatur eller tryk eller endda af reaktionsprodukterne selv.
Sidste artikelHvilke to grupper er metaller klassificeret under?
Næste artikelHvad sker der med en katalysator efter reaktion?
 Varme artikler
Varme artikler
-
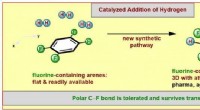 En ny metode til dannelse af fluorerede molekylære ringeillustration af den nye syntetiske metode. Kredit:WWU/Frank Glorius Farvestoffer, lægemidler, og funktionelle materialer er generelt baseret på innovative molekyler fremstillet af kemikere. Til de
En ny metode til dannelse af fluorerede molekylære ringeillustration af den nye syntetiske metode. Kredit:WWU/Frank Glorius Farvestoffer, lægemidler, og funktionelle materialer er generelt baseret på innovative molekyler fremstillet af kemikere. Til de -
 Lys som et værktøj til syntese af komplekse molekylerBlåt lys bruges som et værktøj til syntese af komplekse molekyler kaldet β-aminosyrederivater. Kredit:AG Glorius Kemikere ved universitetet i Münster har udviklet en ny og ligetil måde at producere
Lys som et værktøj til syntese af komplekse molekylerBlåt lys bruges som et værktøj til syntese af komplekse molekyler kaldet β-aminosyrederivater. Kredit:AG Glorius Kemikere ved universitetet i Münster har udviklet en ny og ligetil måde at producere -
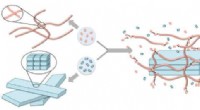 Molekylært stillads hjælper konstruktion på nanoskalaKredit:Okinawa Institute of Science and Technology Graduate University Hvis du vil bygge et højt hus, du skal bruge stillads. Professor Ye Zhang og kolleger ved Okinawa Institute of Science and Te
Molekylært stillads hjælper konstruktion på nanoskalaKredit:Okinawa Institute of Science and Technology Graduate University Hvis du vil bygge et højt hus, du skal bruge stillads. Professor Ye Zhang og kolleger ved Okinawa Institute of Science and Te -
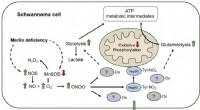 Forskere tager et vigtigt skridt mod kræftbehandlinger, der efterlader sunde celler uskadteForskere har åbnet en mulig vej til nye kræftbehandlinger, der ikke har de bivirkninger, der ofte ledsager mange nuværende kræftbehandlinger ved at identificere en proteinmodifikation, der specifikt u
Forskere tager et vigtigt skridt mod kræftbehandlinger, der efterlader sunde celler uskadteForskere har åbnet en mulig vej til nye kræftbehandlinger, der ikke har de bivirkninger, der ofte ledsager mange nuværende kræftbehandlinger ved at identificere en proteinmodifikation, der specifikt u


