Hvilket element i hvert par har atomer med en større atomradius selen -ilt?
* atomstørrelsestrends: Atomradius øges, når du bevæger dig ned ad en gruppe (kolonne) på den periodiske tabel og falder, når du bevæger dig over en periode (række) fra venstre mod højre.
* placering på den periodiske tabel: Selen er i periode 4, og ilt er i periode 2. Selen er længere nede på det periodiske tabel, hvilket betyder, at dens elektroner er i højere energiniveau og er længere væk fra kernen. Dette resulterer i en større atomradius.
Kortfattet: Selenets atomer er større end iltets atomer på grund af dets lavere position på den periodiske tabel og den øgede afstand mellem dens valenselektroner og kernen.
Sidste artikelHvordan kan vand konverteres til dets bestanddele?
Næste artikelHvad er virkningen af HCI på pH, hvis vand?
 Varme artikler
Varme artikler
-
 En nemmere måde at spise grønt på:Vitamin B12 kan produceres under dejgæringKredit:CC0 Public Domain Vitamin B12 er et essentielt mikronæringsstof, der er nødvendigt for funktioner som vedligeholdelse af nervesystemet og dannelse af blodceller. Imidlertid, B12 findes hove
En nemmere måde at spise grønt på:Vitamin B12 kan produceres under dejgæringKredit:CC0 Public Domain Vitamin B12 er et essentielt mikronæringsstof, der er nødvendigt for funktioner som vedligeholdelse af nervesystemet og dannelse af blodceller. Imidlertid, B12 findes hove -
 En slangebøsse til at skyde stoffer ind på infektionsstedetDen molekylære slangebøsse er kun et par nanometer lang og er sammensat af en syntetisk DNA-streng, der kan belaste et lægemiddel og derefter effektivt fungere som slangebøjlens elastik. Kredit:Marco
En slangebøsse til at skyde stoffer ind på infektionsstedetDen molekylære slangebøsse er kun et par nanometer lang og er sammensat af en syntetisk DNA-streng, der kan belaste et lægemiddel og derefter effektivt fungere som slangebøjlens elastik. Kredit:Marco -
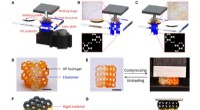 3D-udskrivning meget strækbar hydrogel med forskellige UV-hærdbare polymererMultimateriale 3D -printhydrogel med andre polymerer. (A) Illustration af det DLP-baserede multimateriale 3D-udskrivningsapparat. (B og C) Processer til udskrivning af elastomer- og hydrogelstrukturer
3D-udskrivning meget strækbar hydrogel med forskellige UV-hærdbare polymererMultimateriale 3D -printhydrogel med andre polymerer. (A) Illustration af det DLP-baserede multimateriale 3D-udskrivningsapparat. (B og C) Processer til udskrivning af elastomer- og hydrogelstrukturer -
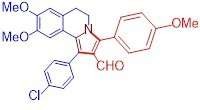 En række stoffer med antitumor -egenskaber syntetiseretStrukturen af en af de resulterende forbindelser (2-aryl-5, 6-dihydropyrrolo [2, 1-α] isoquinoline) Kredit:Maria Matveeva Forskere fra RUDN University har syntetiseret en række nye cytotoksisk
En række stoffer med antitumor -egenskaber syntetiseretStrukturen af en af de resulterende forbindelser (2-aryl-5, 6-dihydropyrrolo [2, 1-α] isoquinoline) Kredit:Maria Matveeva Forskere fra RUDN University har syntetiseret en række nye cytotoksisk
- GRAVITY-instrumentet bryder ny vej inden for exoplanet-billeddannelse
- Hvad er der placeret ved 25 grader nord og 122 øst?
- Af hvilke faktorer afhænger lydhastigheden?
- Jill Brown om, hvorfor virksomheder bliver stemplet som 'onde'
- Undersøgelsen er rettet mod LigM for dets rolle i nedbrydning af aromatiske forurenende stoffer
- Hvilket hav inkluderer koordinaterne 10 grader S 130 E?


