Hvordan kan vand konverteres til dets bestanddele?
Sådan fungerer det:
1. Elektrolyseopsætning: En direkte elektrisk strøm føres gennem vand. Dette gøres ved at fordybe to elektroder (normalt lavet af et inert materiale som platin) i vandet og forbinde dem til en strømkilde.
2. nedbrydning: Når strømmen flyder, giver den den energi, der er nødvendig for at bryde de kemiske bindinger, der holder brint- og iltatomerne sammen i vandmolekyler.
3. Gasudvikling:
* brint (H₂) gas produceres ved den negative elektrode (katode), da hydrogenioner (H+) får elektroner.
* ilt (O₂) gas produceres ved den positive elektrode (anode), da iltioner (O²-) mister elektroner.
Den kemiske reaktion:
Den samlede elektrolyse -reaktion kan repræsenteres som:
2H₂O (L) → 2H₂ (G) + O₂ (G)
Vigtige noter:
* rent vand: Elektrolyse fungerer bedst med let surt eller grundlæggende vand, da rent vand er en dårlig leder af elektricitet.
* sikkerhed: Elektrolyse kan være farlig, hvis den ikke udføres korrekt. Brug altid passende sikkerhedsforholdsregler, især når man beskæftiger sig med elektricitet og brandfarlige gasser.
Anvendelser af elektrolyse:
* brintproduktion: Elektrolyse er en lovende metode til produktion af brint som et rent brændstof.
* Oxygenproduktion: Elektrolyse kan bruges til at generere ilt til forskellige industrielle anvendelser.
* Vandrenhed: Elektrolyse kan bruges til at rense vandet ved at fjerne opløste urenheder.
Fortæl mig, hvis du har andre spørgsmål!
 Varme artikler
Varme artikler
-
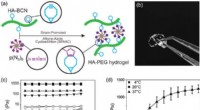 3-D dyrkning af hepatocytter på en lever-på-en-chip-enhed(a) Skematisk repræsentation af dannelsen af HA-PEG-hydrogeler gennem en stamme-promoveret alkyn-azid-cycloadditionsreaktion. (b) Fotografi af en HA-PEG hydrogel efter dannelse. (c) Frekvenssweep af
3-D dyrkning af hepatocytter på en lever-på-en-chip-enhed(a) Skematisk repræsentation af dannelsen af HA-PEG-hydrogeler gennem en stamme-promoveret alkyn-azid-cycloadditionsreaktion. (b) Fotografi af en HA-PEG hydrogel efter dannelse. (c) Frekvenssweep af -
 Løsning af et behåret retsmedicinsk problemKredit:American Chemical Society I årtier, retsmedicinere har testet hårstrå for at afsløre stofbrug eller forgiftning. Men i de senere år, rapporter har sat spørgsmålstegn ved teknikken - især, d
Løsning af et behåret retsmedicinsk problemKredit:American Chemical Society I årtier, retsmedicinere har testet hårstrå for at afsløre stofbrug eller forgiftning. Men i de senere år, rapporter har sat spørgsmålstegn ved teknikken - især, d -
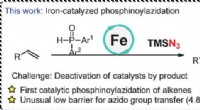 PcFe-katalyseret radikal phosphinoylazidering af alkener med et hurtigt azido-overførselstrinKredit:Dalian Institute of Chemical Physics, Det kinesiske akademis videnskaber Phosphinoylazidation af alkener er en direkte metode til at opbygge nitrogen- og fosforholdige forbindelser fra råst
PcFe-katalyseret radikal phosphinoylazidering af alkener med et hurtigt azido-overførselstrinKredit:Dalian Institute of Chemical Physics, Det kinesiske akademis videnskaber Phosphinoylazidation af alkener er en direkte metode til at opbygge nitrogen- og fosforholdige forbindelser fra råst -
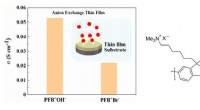 Den første hydroxidledningsevne i anionledende polymer tynde filmFigur 1:Den første måling af hydroxidledningsevne og sammenligning i anionledende polymer tynde film. (X =OH og Br). Kredit:Japan Advanced Institute of Science and Technology Efterhånden som dekar
Den første hydroxidledningsevne i anionledende polymer tynde filmFigur 1:Den første måling af hydroxidledningsevne og sammenligning i anionledende polymer tynde film. (X =OH og Br). Kredit:Japan Advanced Institute of Science and Technology Efterhånden som dekar
- Webb afslører dampende atmosfære fra en fjern planet i detaljer
- Klædt på til at forbinde:bærbar teknologi udvider sig over hele kroppen
- Hvad er karagandabassinet berømt for minedrift af?
- Hvor mange PT er der i en fl oz?
- Hvor mange elementer er i C3H8 + 5O2—> 3CO2 4H2O?
- Hvad hedder klipper, der rammer overfladen?


